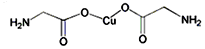
题目内容
2.下列说法正确的是( )| A. | Li在氧气中燃烧主要生成Li2O2 | |
| B. | 碱金属元素单质都能保存于煤油中 | |
| C. | 卤族元素单质的熔、沸点随原子序数的增大而升高而碱金属元素单质的熔、沸点随原子序数的增大而降低 | |
| D. | 第二周期非金属元素的气态氢化物溶于水后所得水溶液均呈酸性 |
分析 A.Li金属性比Na的弱,燃烧不生成Li2O2;
B.锂单质的密度比煤油小,不能保存在煤油中;
C.卤素单质的熔沸点,随原子序数的增大而升高,而碱金属单质的熔沸点恰好相反;
D.氨气溶于水,溶液显碱性.
解答 解:A.Li金属性比Na的弱,Li与氧气反应生成Li2O,不会生成Li2O2,故A错误;
B.保存在煤油中的碱金属单质的密度必须大于煤油,锂单质的密度比煤油小,需要保存在石蜡油中,故B错误;
C.组成结构相似的分子晶体,相对分子质量越大,熔沸点越高,卤族元素单质随原子序数相对分子质量增大,则熔沸点升高;而碱金属单质的熔沸点随原子序数的增大而降低,故C正确;
D.第二周期非金属元素的气态氢化物溶于水后,水溶液不一定为酸性,如氨气溶于水,溶液显碱性,故D错误;
故选C.
点评 本题考查元素周期律的内容及应用,题目难度不大,明确元素周期律的内容为解答关键,B为易错点,注意常见药品的性质及保存方法,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
1.资料显示:O2的氧化性随溶液pH的增大逐渐减弱.室温下,某学习小组利用下图装置探究不同条件下KI与O2的反应,实验记录如下.
回答下列问题:
(1)实验③的目的是验证Cl-是否影响KI与O2的反应.
(2)实验②中发生反应的离子方程式是4I-+O2+4H+=2I2+2H2O.
(3)实验②比实验④溶液颜色深的原因是其他条件相同时,HCl是强电解质,溶液中c(H+)较醋酸大,O2的氧化性较强.
为进一步探究KI与O2的反应,用上述装置继续进行实验:
对于实验⑥的现象.甲同学猜想“pH=10时O2不能氧化I-”,他设计了下列装置进行实验以验证猜想.
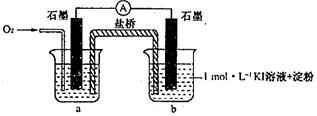
(4)烧杯a中的溶液为pH=10的KOH溶液.
(5)实验结果表明此猜想不成立.支持该结论的实验现象是:通入O2后,电流表指针偏转,烧杯b中的溶液逐渐变蓝色.
(6)乙同学向pH=10的“KOH一淀粉溶液”中滴加碘水,溶液先变蓝后迅速褪色,经检测褪色后的溶液中含有IO3-,用离子方程式表示退色的原因是3I2+6OH-=IO3-+5I-+3H2O.
(7)该小组同学对实验过程进行了整体反思,推测实验①和实验⑥的现象产生的原因分别可能是中性条件下,O2的氧化性比较弱,短时间内难以生成“一定量”碘单质使溶液颜色发生变化;pH=10的KOH溶液中I-被氧化生成I2,I2迅速发生歧化反应变为IO3-和I-.
| 序号 | 烧杯中的液体 | 5分钟后现象 |
| ① | 2mL 1mol•L-1KI溶液+5滴淀粉 | 无明显变化 |
| ② | 2mL1mol•L-1KI 溶液+5 滴淀粉+2mL0.2mol•L-1HC1 | 溶液变蓝 |
| ③ | 2mLl mol•L-1KI溶液+5滴淀粉+2mL0.2mol•L-1KC1 | 无明显变化 |
| ④ | 2mL1mol•L-1KI溶液+5滴淀粉+2mL0.2mol•L-1CH3COOH | 溶液变蓝,颜色 较②浅 |
(1)实验③的目的是验证Cl-是否影响KI与O2的反应.
(2)实验②中发生反应的离子方程式是4I-+O2+4H+=2I2+2H2O.
(3)实验②比实验④溶液颜色深的原因是其他条件相同时,HCl是强电解质,溶液中c(H+)较醋酸大,O2的氧化性较强.
为进一步探究KI与O2的反应,用上述装置继续进行实验:
| 序号 | 烧杯中的液体 | 5小时后现象 |
| ⑤ | 2mL混有KOH的pH=8.5的lmol•L-1KI溶液+5滴淀粉 | 溶液略变蓝 |
| ⑥ | 2mL混有KOH的pH=10的lmol•L-1KI溶液+5滴淀粉 | 无明显变化 |

(4)烧杯a中的溶液为pH=10的KOH溶液.
(5)实验结果表明此猜想不成立.支持该结论的实验现象是:通入O2后,电流表指针偏转,烧杯b中的溶液逐渐变蓝色.
(6)乙同学向pH=10的“KOH一淀粉溶液”中滴加碘水,溶液先变蓝后迅速褪色,经检测褪色后的溶液中含有IO3-,用离子方程式表示退色的原因是3I2+6OH-=IO3-+5I-+3H2O.
(7)该小组同学对实验过程进行了整体反思,推测实验①和实验⑥的现象产生的原因分别可能是中性条件下,O2的氧化性比较弱,短时间内难以生成“一定量”碘单质使溶液颜色发生变化;pH=10的KOH溶液中I-被氧化生成I2,I2迅速发生歧化反应变为IO3-和I-.
10.下列各项比较中前者高于(或大于或强于)后者的是( )
| A. | 金属Mg和金属Cu的空间利用率 | |
| B. | BF3和CH4中心原子的价层电子对数 | |
| C. | 邻羟基苯甲醛(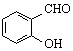 )和对羟基苯甲醛( )和对羟基苯甲醛(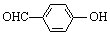 )的沸点 )的沸点 | |
| D. | C-O和Si-O的键能 |
17.下列说法正确的是( )
| A. | 绿色植物的光合作用是把热能转化为化学能的过程 | |
| B. | 生物质能是与化学反应无关的一种能源 | |
| C. | 物质燃烧一定是放热反应 | |
| D. | 化学能只能以热能的形式释放 |
14.下列说法正确的是( )
| A. | 铅蓄电池是常见的二次电池,性能优良,比能量高,缺点是废弃电池铅污染严重 | |
| B. | 用玻璃棒蘸取KMnO4(H+)溶液,滴在pH试纸上,然后与标准比色卡对照,测定其pH | |
| C. | 石油的分馏、蛋白质的盐析、焰色反应、煤的液化与气化都是物理变化 | |
| D. | 在元素周期表的金属和非金属分界线附近可寻找锗、硅、硒等半导体材料 |
11.下列原子或离子对应的结构示意图不正确的是( )
| A. | Be | B. | K+ | C. | Cl- | D. | N |