题目内容
金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”.
(1)Ti基态原子的电子排布式为 .
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物.电负性:C (填“>”或“<”下同)B;第一电离能:N O.
(3)月球岩石--玄武岩的主要成分为钛酸亚铁(FeTiO3). FeTiO3与80%的硫酸反应可生成TiOSO4.SO42-的空间构型为 形,其中硫原子采用 杂化.
(4)磷酸钛〔Ti3(PO4)4]锂离子电池能量密度大、安全性高.Ti3(PO4)4可由TiOSO4与H3PO4反应制得.两分子H3PO4发生脱水生成焦磷酸;则三分子H3PO4脱去两分子H2O生成三磷酸,其结构式为 ,四分子H3PO4 脱去四分子H2O生成的四偏磷酸属于 元酸.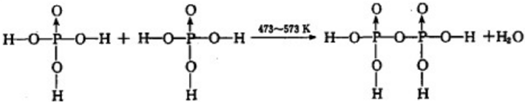
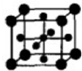
(5)Ti的氧化物和CaO相互作用能形成钛酸盐CaTiO3,CaTiO3的晶体结构如图所示(Ti4+位于立方体的顶点).该晶体中,Ti4+和周围 个O2-相紧邻.
(6)Fe能形成多种氧化物,其中FeO晶胞结构为NaCI型.晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重大影响.由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为FexO(x<1)中,若测得某FexO晶体密度为5.71g?cm-3,晶胞边长为4.28X10-10 m,则FexO中x= .
(1)Ti基态原子的电子排布式为
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物.电负性:C
(3)月球岩石--玄武岩的主要成分为钛酸亚铁(FeTiO3). FeTiO3与80%的硫酸反应可生成TiOSO4.SO42-的空间构型为
(4)磷酸钛〔Ti3(PO4)4]锂离子电池能量密度大、安全性高.Ti3(PO4)4可由TiOSO4与H3PO4反应制得.两分子H3PO4发生脱水生成焦磷酸;则三分子H3PO4脱去两分子H2O生成三磷酸,其结构式为

(5)Ti的氧化物和CaO相互作用能形成钛酸盐CaTiO3,CaTiO3的晶体结构如图所示(Ti4+位于立方体的顶点).该晶体中,Ti4+和周围

(6)Fe能形成多种氧化物,其中FeO晶胞结构为NaCI型.晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重大影响.由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为FexO(x<1)中,若测得某FexO晶体密度为5.71g?cm-3,晶胞边长为4.28X10-10 m,则FexO中x=
考点:晶胞的计算,元素电离能、电负性的含义及应用,判断简单分子或离子的构型,原子轨道杂化方式及杂化类型判断
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:(1)根据构造原理写出Ti基态原子的电子排布式;
(2)同一周期元素,元素的电负性随着原子序数的增大而增大,元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族和第VA族元素第一电离能大于其相邻元素,原子的轨道中电子处于半满、全满、全空时比较稳定;
(3)根据价层电子对互斥理论确定其空间构型、杂化方式;
(4)三分子磷酸可脱去两分子水生成三磷酸,分子式为H5P3O10,P-O键没有变,氢原子都是与氧原子相连;
(5)根据晶胞中微粒所在位置计算配位数.
(6)根据晶胞结构、晶胞的密度和晶胞边长求出x值.
(2)同一周期元素,元素的电负性随着原子序数的增大而增大,元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族和第VA族元素第一电离能大于其相邻元素,原子的轨道中电子处于半满、全满、全空时比较稳定;
(3)根据价层电子对互斥理论确定其空间构型、杂化方式;
(4)三分子磷酸可脱去两分子水生成三磷酸,分子式为H5P3O10,P-O键没有变,氢原子都是与氧原子相连;
(5)根据晶胞中微粒所在位置计算配位数.
(6)根据晶胞结构、晶胞的密度和晶胞边长求出x值.
解答:
解:(1)Ti是22号元素,原子核外有22个电子,根据构造原理知Ti基态原子的电子排布式为1s22s22p63s23p63d24s2;
故答案为:1s22s22p63s23p63d24s2;
(2)C和B属于同一周期且C的原子序数大于B,所以电负性C>B,N原子中2p轨道处于半充满状态,O原子中2p轨道既不是半充满也不是全空或全满,所以N原子第一电离能比O原子大;
故答案为:>;>;
(3)SO42-中价电子数=4+
(6+2-4×2)=4,且硫酸根离子中不含孤电子对,所以硫酸根离子呈正四面体构型,采用sp3杂化;
故答案为:正四面体;sp3;
(4)三分子磷酸可脱去两分子水生成三磷酸,分子式为H5P3O10,P-O键没有变,氢原子都是与氧原子相连,结构式为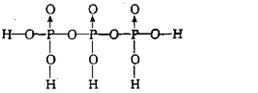 ;
;
四分子H3PO4 脱去四分子H2O生成的四磷酸,四磷酸脱去一分子H2O生成四偏磷酸,故四偏磷酸属于四元酸;
故答案为: ;四;
;四;
(5)O2-、Ti4+分别位于立方体的面心和顶点,与顶点Ti4+紧邻等距离最近的O2-位于晶胞的三个平面,即横平面、正平面和侧平面,将每个平面扩展,则每个平面中距离Ti4+最近的O2-均有4个,故共有3×4=12;
故答案为:12;
(6)FexO晶体的晶胞结构为NaCl型,所以每个晶胞中含有4个FexO,根据m=ρV得:(56x+16)×
=5.71g?cm-3×(4.28X10-10 m×100)3,解得:x=0.92.
故答案为:0.92.
故答案为:1s22s22p63s23p63d24s2;
(2)C和B属于同一周期且C的原子序数大于B,所以电负性C>B,N原子中2p轨道处于半充满状态,O原子中2p轨道既不是半充满也不是全空或全满,所以N原子第一电离能比O原子大;
故答案为:>;>;
(3)SO42-中价电子数=4+
| 1 |
| 2 |
故答案为:正四面体;sp3;
(4)三分子磷酸可脱去两分子水生成三磷酸,分子式为H5P3O10,P-O键没有变,氢原子都是与氧原子相连,结构式为
 ;
;四分子H3PO4 脱去四分子H2O生成的四磷酸,四磷酸脱去一分子H2O生成四偏磷酸,故四偏磷酸属于四元酸;
故答案为:
 ;四;
;四;(5)O2-、Ti4+分别位于立方体的面心和顶点,与顶点Ti4+紧邻等距离最近的O2-位于晶胞的三个平面,即横平面、正平面和侧平面,将每个平面扩展,则每个平面中距离Ti4+最近的O2-均有4个,故共有3×4=12;
故答案为:12;
(6)FexO晶体的晶胞结构为NaCl型,所以每个晶胞中含有4个FexO,根据m=ρV得:(56x+16)×
| 4 |
| NA |
故答案为:0.92.
点评:本题考查较为综合,涉及多个方面的知识,题目难度较大,注意晶体类型以及对数据的分析和判断,学习中注重相关基础知识和解题方法的积累.

练习册系列答案
相关题目
已知反应:①101kPa时,2C(s)+O2(g)═2CO(g)△H=-221kJ/mol;②稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol.
下列结论正确的是( )
下列结论正确的是( )
| A、稀硫酸与稀NaOH溶液的中和热为57.3 kJ/mol |
| B、①的反应热为221 kJ/mol |
| C、稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol |
| D、稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O═NaBO2+4H2↑.下列说法中正确的是( )
| A、被氧化的元素与被还原的元素质量比为1:4 |
| B、NaBH4既是氧化剂又是还原剂 |
| C、NaBH4是还原剂,H2O是氧化剂 |
| D、硼元素被氧化,氢元素被还原 |
已知某温度下,在100mL浓度为0.01mol/L的NaHB强电解质溶液中,c(H+)>(OH-),则下列关系式一定正确的是( )
| A、溶液的pH=2 |
| B、c(Na+)=0.01 mol/L≥c(B2-) |
| C、c (H+)?c(OH-)=10-14 |
| D、c(Na+)+c(H+)=c(HB-)+c(B2-)+c(OH-) |
下列实验能达到目的是( )
| A、用湿润的碘化钾淀粉试纸鉴别Br2(g)和NO2 |
| B、用稀硫酸和锌粒反应制氢气时加入少许硫酸铜以加快反应速率 |
| C、用量筒量取10.00mL 1.00mol?L-1盐酸于100mL容量瓶中,加水稀释至刻度,可配制0.100 mol?L-1盐酸 |
| D、除去乙酸乙酯中混有的少量乙酸:加入NaOH溶液并加热,振荡、静置后分液 |
化合物A是一种新型杀虫剂,结构简式如图.则下列说法正确的是( )
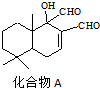

| A、化合物A分子中含有手性碳原子 |
| B、1mol化合物A与H2加成时最多可消耗1mol H2 |
| C、化合物A分子中所有碳原子共平面 |
| D、化合物A在浓硫酸作用下加热可发生消去反应 |
X、Y、Z三种气体,取X和Y按1:1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y?2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于( )
| A、33.3% | B、40% |
| C、50% | D、66.7% |
下列物质能使干燥的蓝色石蕊试纸先变红后退色的是( )
①氯气 ②液氯 ③新制氯水 ④氯气的酒精溶液 ⑤盐酸 ⑥盐酸酸化的漂白粉溶液.
①氯气 ②液氯 ③新制氯水 ④氯气的酒精溶液 ⑤盐酸 ⑥盐酸酸化的漂白粉溶液.
| A、①②③ | B、①②③⑥ |
| C、④⑥ | D、③⑥ |