题目内容
在标准状况下,测得1.92g某气体的体积627mL,则此气体的摩尔质量为 .
考点:物质的量的相关计算
专题:计算题
分析:结合n=
、M=
计算.
| V |
| Vm |
| m |
| n |
解答:
解:标准状况下,测得1.92g某气体的体积627mL,气体的物质的量为
=0.03mol,M=
=64g/mol,
故答案为:64g/mol.
| 0.672L |
| 22.4L/mol |
| 1.92g |
| 0.03g/mol |
故答案为:64g/mol.
点评:本题考查物质的量的计算,为高频考点,把握物质的量的有关计算公式及转化关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
在电解水时,为了增强导电性,加入的电解质最好选用( )
| A、HCl |
| B、CuCl2 |
| C、Na2SO4 |
| D、CuSO4 |
在密闭容器中,一定量混合气体发生下列反应:aA(g)+bB(g)?cC(g)+dD(g) 达到平衡后,测得C气体的浓度为0.5mol/L.当在恒温下,将密闭容器的体积缩小为
,再达平衡时,测得C气体的浓度为0.9mol/L.则下列叙述正确的是( )
| 1 |
| 2 |
| A、反应速率降低 |
| B、平衡向右移动 |
| C、B的转化率提高 |
| D、a+b<c+d |
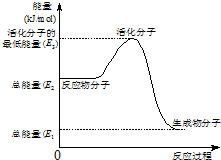 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是①CH3OH(g)+H2O(g)→CO2(g)+3H2(g)-49.0kJ
②CH3OH(g)+1/2O2(g)→CO2(g)+2H2(g)+192.9kJ
下列说法正确的是( )
| A、1molCH3OH完全燃烧放出热量192.9 kJ |
| B、②中的能量变化如图所示,则Q=E3-E1 |
| C、H2燃烧能放出大量的热,故CH3OH转变成H2的过程必须吸收热量 |
| D、根据②推知:在25℃,101 kPa时,1 molCH3OH(g)完全燃烧生成CO2和H2O放出的热量应大于192.9 kJ |
下列实验方案合理的是( )
| A、配制50 g质量分数为5% NaCl溶液:将45 mL水加入到盛有5 g NaCl的烧杯中,搅拌溶解 |
B、 制备乙酸乙酯:用如图所示的实验装置 |
| C、鉴定SO42-:向溶液中加入盐酸酸化的氯化钡溶液 |
| D、鉴别环已烯和苯:将溴的四氯化碳溶液分别滴加到少量环已烯和苯中 |
 电解装置如图所示.图中B装置盛1L2mol?L-1的Na2SO4溶液,A装置中盛1L2mol?L-1 AgNO3溶液.通电后,湿润的淀粉KI试纸的C端变蓝色.电解一段时间后,试回答:
电解装置如图所示.图中B装置盛1L2mol?L-1的Na2SO4溶液,A装置中盛1L2mol?L-1 AgNO3溶液.通电后,湿润的淀粉KI试纸的C端变蓝色.电解一段时间后,试回答: