题目内容
在一个容积为500mL的密闭容器中,充入2molCO2和3molH2,在一定温度和压强下发生如下反应:
CO2(g)+H2(g)?CO(g)+H2O(g)
经5min后达到平衡状态,此时测得CO气体的浓度为2.4mol?L-1.回答下列问题:
(1)以H2的浓度变化表示的该反应的速率为 ;
(2)该温度下,反应的化学平衡常数K= ;
(3)达平衡时CO2的转化率为 ;
(4)在相同条件下,若在同一容器中改为加入1molCO2、1molCO和1mol水蒸气,欲使平衡后CO气体的浓度仍为2.4mol?L-1,则还需向容器中加入 molH2.
CO2(g)+H2(g)?CO(g)+H2O(g)
经5min后达到平衡状态,此时测得CO气体的浓度为2.4mol?L-1.回答下列问题:
(1)以H2的浓度变化表示的该反应的速率为
(2)该温度下,反应的化学平衡常数K=
(3)达平衡时CO2的转化率为
(4)在相同条件下,若在同一容器中改为加入1molCO2、1molCO和1mol水蒸气,欲使平衡后CO气体的浓度仍为2.4mol?L-1,则还需向容器中加入
考点:化学平衡的计算,反应速率的定量表示方法,化学平衡常数的含义
专题:化学平衡专题
分析:(1)可以计算出用CO浓度变化表示的反应速率,再根据速率之比等于计量数之比,得出答案;
(2)平衡常数为产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值;
(3)平衡转化率=
×100%;
(4)使平衡后CO气体的浓度仍为2.4mol?L-1,与原平衡完全一致,所以按化学计量数之比转化到左边时必须与两种反应物的物质的量完全相同.
(2)平衡常数为产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值;
(3)平衡转化率=
| 已转化的反应物浓度 |
| 反应物原始浓度 |
(4)使平衡后CO气体的浓度仍为2.4mol?L-1,与原平衡完全一致,所以按化学计量数之比转化到左边时必须与两种反应物的物质的量完全相同.
解答:
解:c(CO2)=
=4mol?L-1,c(H2)=
=6mol?L-1
CO2(g)+H2(g)?CO(g)+H2O(g)
起始浓度:4mol?L-1 6mol?L-1 0 0
转化浓度:2.4mol?L-1 2.4mol?L-1 2.4mol?L-1 2.4mol?L-1
平衡浓度:1.6mol?L-1 3.6mol?L-1 2.4mol?L-1 2.4mol?L-1
(1)v( H2)=v(CO)=
=0.48mol?L-1?min-1,故答案为:0.48mol?L-1?min-1;
(2)写出化学平衡常数计算式k=
=
=1,故答案为:1;
(3)写出CO2转化率计算式
×100%=
×100%=60%,故答案为:60%;
(4)按化学计量数之比转化到左边时,得到2mol CO2和1molH2,若与原平衡完全一致,还需要2molH2,故答案为:2.
| 2mol |
| 0.5L |
| 3mol |
| 0.5L |
CO2(g)+H2(g)?CO(g)+H2O(g)
起始浓度:4mol?L-1 6mol?L-1 0 0
转化浓度:2.4mol?L-1 2.4mol?L-1 2.4mol?L-1 2.4mol?L-1
平衡浓度:1.6mol?L-1 3.6mol?L-1 2.4mol?L-1 2.4mol?L-1
(1)v( H2)=v(CO)=
| 2.4mol?L-1 |
| 5min |
(2)写出化学平衡常数计算式k=
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| 2.4×2.4 |
| 1.6×3.6 |
(3)写出CO2转化率计算式
| c转化(CO2) |
| c起始(CO2) |
| 2.4 |
| 6 |
(4)按化学计量数之比转化到左边时,得到2mol CO2和1molH2,若与原平衡完全一致,还需要2molH2,故答案为:2.
点评:本题考查化学平衡移动、计算及等效平衡,难度较高;解决此类问题时可以利用化学平衡的三段式进行计算;注意理解等效平衡,如果使各物质的浓度与原平衡一致,必须与原平衡的反应物物质的量完全一致

练习册系列答案
相关题目
在溶液中能大量共存的离子组是( )
| A、H+、OH-、Na+ |
| B、K+、NO3-、Cu2+ |
| C、Ba2+、SO42-、Na+ |
| D、Fe3+、OH-、NH4+ |
碳可以多种形式存在.金刚石、C60和石墨( )
| A、互为同位素 |
| B、为同一物质 |
| C、互为同素异形体 |
| D、互为同分异构体 |
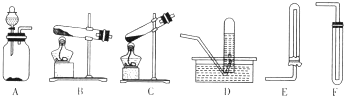
 三氯化铁是中学化学实验室中必不可少的重要试剂.某兴趣小组利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备 FeCl3?6H2O,该同学设计的实验装置如图所示,A中放有m克废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中加过量的稀盐酸,此时溶液呈浅绿色,再打开b 进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使多余HNO3分解,再降温结晶得FeCl3?6H2O晶体.
三氯化铁是中学化学实验室中必不可少的重要试剂.某兴趣小组利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备 FeCl3?6H2O,该同学设计的实验装置如图所示,A中放有m克废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中加过量的稀盐酸,此时溶液呈浅绿色,再打开b 进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使多余HNO3分解,再降温结晶得FeCl3?6H2O晶体.