题目内容
 三氯化铁是中学化学实验室中必不可少的重要试剂.某兴趣小组利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备 FeCl3?6H2O,该同学设计的实验装置如图所示,A中放有m克废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中加过量的稀盐酸,此时溶液呈浅绿色,再打开b 进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使多余HNO3分解,再降温结晶得FeCl3?6H2O晶体.
三氯化铁是中学化学实验室中必不可少的重要试剂.某兴趣小组利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备 FeCl3?6H2O,该同学设计的实验装置如图所示,A中放有m克废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中加过量的稀盐酸,此时溶液呈浅绿色,再打开b 进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使多余HNO3分解,再降温结晶得FeCl3?6H2O晶体.填写下列空白:
(1)如何检查装置A的气密性:
(2)滴加盐酸时,发现反应速率较之同浓度盐酸与纯铁粉反应要快,其原因是
(3)将烧杯内溶液用蒸发、浓缩、再降温结晶法制得FeCl3?6H2O晶体,而不用直接蒸发结晶的方法来制得晶体的理由
(4)用该法制得的晶体中往往混有Fe (NO3)3,为了制得较纯净的FeCl3?6H2O,可将烧杯内的稀硝酸换成
(5)若要测废铁屑的纯度,可测出从B中放出气体的体积V (已折算成标准状况,单位:L),则废铁屑的纯度为:
考点:制备实验方案的设计,铁的化学性质
专题:几种重要的金属及其化合物
分析:实验的目的是制备FeCl3?6H2O,由装置图可知,在A中,废铁屑与盐酸反应生成氯化亚铁,经过滤可分离出铜,氯化亚铁和过量的盐酸流入烧杯中,硝酸将氯化亚铁氧化生成氯化铁,经蒸发浓缩反应液,可制得FeCl3?6H2O,另外在C中补充量气装置,可测得铁的含量.
(1)检验装置的气密性可以用加热法和注水法,从形成压强差的角度思考检查气密性的方法,
(2)粗铁粉易形成原电池反应;
(3)直接蒸发结晶FeCl3?6H2O时,因为FeCl3+3H2O?Fe(OH)3+3HCl,HCl逸出使得水解正向进行,因此得不到FeCl3?6H2O;
(4)不引入杂质并能将FeCl2氧化的物质是Cl2或H2O2;
(5)在框图C中应补充量气装置,根据氢气的体积可确定铁的质量,进而计算纯度.
(1)检验装置的气密性可以用加热法和注水法,从形成压强差的角度思考检查气密性的方法,
(2)粗铁粉易形成原电池反应;
(3)直接蒸发结晶FeCl3?6H2O时,因为FeCl3+3H2O?Fe(OH)3+3HCl,HCl逸出使得水解正向进行,因此得不到FeCl3?6H2O;
(4)不引入杂质并能将FeCl2氧化的物质是Cl2或H2O2;
(5)在框图C中应补充量气装置,根据氢气的体积可确定铁的质量,进而计算纯度.
解答:
解:实验的目的是制备FeCl3?6H2O,由装置图可知,在A中,废铁屑与盐酸反应生成氯化亚铁,经过滤可分离出铜,氯化亚铁和过量的盐酸流入烧杯中,硝酸将氯化亚铁氧化生成氯化铁,经蒸发浓缩反应液,可制得FeCl3?6H2O,另外在C中补充量气装置,可测得铁的含量,
(1)检验装置的气密性可以用加热法和注水法,分别是关闭活塞a、活塞b,打开分液漏斗活塞和瓶盖,从中注水,漏斗下端会形成一段液柱,一段时间后,若液柱缓缓下移,说明气密性不好,若液柱停止不动,则说明气密性好,或关闭分液漏斗活塞和活塞b,打开活塞a,将管口B接一段带玻璃管的乳胶管并引入水槽中,用双手捂住装置A,若水槽中有气泡产生,放开双手玻璃管中形成一段液柱,则气密性良好,
故答案为:①关闭活塞a、活塞b,打开分液漏斗活塞和瓶盖,从中注水,漏斗下端会形成一段液柱,一段时间后,若液柱缓缓下移,说明气密性不好,若液柱停止不动,则说明气密性好.②关闭分液漏斗活塞和活塞b,打开活塞a,将管口B接一段带玻璃管的乳胶管并引入水槽中,用双手捂住装置A,若水槽中有气泡产生,放开双手玻璃管中形成一段液柱,则气密性良好;
(2)铁粉中含有铜,铁比铜活泼,形成原电池反应,反应速率增大,
故答案为:铁粉与杂质铜形成原电池反应,加快了反应速率;
(3)直接蒸发结晶FeCl3?6H2O时,因为FeCl3+3H2O?Fe(OH)3+3HCl,HCl逸出使得水解正向进行,因此得不到FeCl3?6H2O,在酸性溶液中加热,可抑制水解,防止生成氢氧化铁,
故答案为:因为氯化铁是强酸弱碱盐水解生成氢氧化铁和盐酸,加热蒸干时使HCl 挥发造成水解平衡右移,因此得不到FeCl3?6H2O晶体;
(4)不引入杂质并能将FeCl2氧化的物质是Cl2或H2O2,故答案为:双氧水或新制氯水;
(5)产生的气体为氢气. Fe+2HCl=FeCl2+H2↑
56 g 22.4 L
m(Fe) V L
m(Fe)=
g,
则ω((Fe)=
×100%=
×100%,
要测量气体的体积,应在框图C中应补充量气装置,如 ,
,
故答案为:
×100%; .
.
(1)检验装置的气密性可以用加热法和注水法,分别是关闭活塞a、活塞b,打开分液漏斗活塞和瓶盖,从中注水,漏斗下端会形成一段液柱,一段时间后,若液柱缓缓下移,说明气密性不好,若液柱停止不动,则说明气密性好,或关闭分液漏斗活塞和活塞b,打开活塞a,将管口B接一段带玻璃管的乳胶管并引入水槽中,用双手捂住装置A,若水槽中有气泡产生,放开双手玻璃管中形成一段液柱,则气密性良好,
故答案为:①关闭活塞a、活塞b,打开分液漏斗活塞和瓶盖,从中注水,漏斗下端会形成一段液柱,一段时间后,若液柱缓缓下移,说明气密性不好,若液柱停止不动,则说明气密性好.②关闭分液漏斗活塞和活塞b,打开活塞a,将管口B接一段带玻璃管的乳胶管并引入水槽中,用双手捂住装置A,若水槽中有气泡产生,放开双手玻璃管中形成一段液柱,则气密性良好;
(2)铁粉中含有铜,铁比铜活泼,形成原电池反应,反应速率增大,
故答案为:铁粉与杂质铜形成原电池反应,加快了反应速率;
(3)直接蒸发结晶FeCl3?6H2O时,因为FeCl3+3H2O?Fe(OH)3+3HCl,HCl逸出使得水解正向进行,因此得不到FeCl3?6H2O,在酸性溶液中加热,可抑制水解,防止生成氢氧化铁,
故答案为:因为氯化铁是强酸弱碱盐水解生成氢氧化铁和盐酸,加热蒸干时使HCl 挥发造成水解平衡右移,因此得不到FeCl3?6H2O晶体;
(4)不引入杂质并能将FeCl2氧化的物质是Cl2或H2O2,故答案为:双氧水或新制氯水;
(5)产生的气体为氢气. Fe+2HCl=FeCl2+H2↑
56 g 22.4 L
m(Fe) V L
m(Fe)=
| 56V |
| 22.4 |
则ω((Fe)=
| ||
| m |
| 56V |
| 22.4m |
要测量气体的体积,应在框图C中应补充量气装置,如
 ,
,故答案为:
| 56V |
| 22.4m |
 .
.
点评:本题考查制备实验方案的设计,侧重于学生的分析能力、实验能力和计算能力的考查,为高考常见题型和高频考点,注意把握实验的目的和原理,为解答该题的关键,难度不大.

练习册系列答案
相关题目
 如图所示原电池装置中,电解质溶液为硫酸,下列有关叙述错误的是( )
如图所示原电池装置中,电解质溶液为硫酸,下列有关叙述错误的是( )| A、锌做负极发生氧化反应 |
| B、供电时的总反应为:Zn+2H+=Zn2++H2 |
| C、该装置可实现化学能转化为电能 |
| D、产生1molH2,消耗锌的质量32.5g |
下列物质互为同素异形体的是( )
| A、126C和146C |
| B、氧气和臭氧 |
| C、甲烷和乙烷 |
| D、正丁烷和异丁烷 |
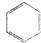 看,分子中含有碳碳双键,由此推测,苯能使酸性高锰酸钾溶液褪色且苯的6个碳原子之间的键有两种.
看,分子中含有碳碳双键,由此推测,苯能使酸性高锰酸钾溶液褪色且苯的6个碳原子之间的键有两种. Ⅰ、碘钨灯具有使用寿命长、节能环保等优点.一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+I2(g)?WI2(g).
Ⅰ、碘钨灯具有使用寿命长、节能环保等优点.一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+I2(g)?WI2(g). ,俗名为水杨酸,在 医学上具有解热镇痛和抗炎、抗风湿作用,由于它具有酸性而刺激胃肠道产生严重的反应,因此通常将它先转化为乙酰水杨酸(阿司匹林),服用后在人体内会缓慢反应生成水杨酸:
,俗名为水杨酸,在 医学上具有解热镇痛和抗炎、抗风湿作用,由于它具有酸性而刺激胃肠道产生严重的反应,因此通常将它先转化为乙酰水杨酸(阿司匹林),服用后在人体内会缓慢反应生成水杨酸: