题目内容
如图中,A、B、C是气体发生装置.D、E、F是气体收集装置.
试回答:
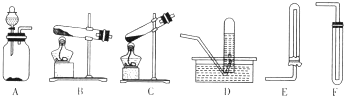
(1)甲同学要制取氨气,应将 (填装置的字母代号,下同)两装置相连.实验室制取NH3的化学方程式为 .
(2)乙同学用过氧化氢与MnO2混合制氧气,应将 两装置相连.
(3)丙同学将甲、乙两同学制得的NH3与O2在一定条件下反应制取HNO3:
4NH3+5O2
4NO+6H2O.
2NO+O2=2NO2
3NO2+H2O=2HNO3+NO.
总反应式为:NH3+2O2=HNO3+H2O
若反应最终无任何气体剩余,则所得硝酸溶液的质量分数为 .
试回答:

(1)甲同学要制取氨气,应将
(2)乙同学用过氧化氢与MnO2混合制氧气,应将
(3)丙同学将甲、乙两同学制得的NH3与O2在一定条件下反应制取HNO3:
4NH3+5O2
| ||
| △ |
2NO+O2=2NO2
3NO2+H2O=2HNO3+NO.
总反应式为:NH3+2O2=HNO3+H2O
若反应最终无任何气体剩余,则所得硝酸溶液的质量分数为
考点:制备实验方案的设计,化学方程式的有关计算
专题:实验题,计算题
分析:(1)实验室用氯化铵和氢氧化钙在加热条件下反应制备氨气,因氨气密度比空气小,可用向下排空法收集;
(2)过氧化氢与MnO2混合制氧气,二氧化锰起到催化剂的作用,可用排水发生收集氧气;
(3)根据反应的总方程式NH3+2O2=HNO3+H2O计算.
(2)过氧化氢与MnO2混合制氧气,二氧化锰起到催化剂的作用,可用排水发生收集氧气;
(3)根据反应的总方程式NH3+2O2=HNO3+H2O计算.
解答:
解:(1)实验室用氯化铵和氢氧化钙在加热条件下反应制备氨气,
反应的方程式为2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,因氨气密度比空气小,可用向下排空法收集,则选择的仪器为B、E,
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;B、E;
(2)过氧化氢与MnO2混合制氧气,二氧化锰起到催化剂的作用,可用排水发生收集氧气,则选择的仪器为A、D,故答案为:A、D;
(3)反应最终无任何气体剩余,则完全反应,发生NH3+2O2=HNO3+H2O,
设生成1molHNO3,1molH2O,
则m(HNO3)=63g,m(H2O)=18g,
所以溶液的质量分数为
×100%=77.8%,
故答案为:77.8%.
反应的方程式为2NH4Cl+Ca(OH)2
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
(2)过氧化氢与MnO2混合制氧气,二氧化锰起到催化剂的作用,可用排水发生收集氧气,则选择的仪器为A、D,故答案为:A、D;
(3)反应最终无任何气体剩余,则完全反应,发生NH3+2O2=HNO3+H2O,
设生成1molHNO3,1molH2O,
则m(HNO3)=63g,m(H2O)=18g,
所以溶液的质量分数为
| 63g |
| 63g+18g |
故答案为:77.8%.
点评:本题考查较为综合,涉及常见气体的制备和计算,侧重于学生的分析能力、实验能力和计算能力的考查,为高频考点,注意把握物质的性质以及实验室制备方法,注重基础知识的积累,难度不大.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
下列化工生产过程中所发生的反应不属于氧化还原反应的是( )
| A、用油脂制肥皂 |
| B、用铝土矿制金属铝 |
| C、用氯气和消石灰制漂白 |
| D、用氢气和氮气合成氨 |
使用“一次性餐具”是预防肝炎传染的措施之一,从防疫和环保的角度考虑,你认为下列“一次性餐具”最有发展前景的是( )
| A、瓷器餐具 | B、淀粉餐具 |
| C、塑料餐具 | D、银制餐具 |
 ,则其单体的结构简式为
,则其单体的结构简式为


 Ⅰ、碘钨灯具有使用寿命长、节能环保等优点.一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+I2(g)?WI2(g).
Ⅰ、碘钨灯具有使用寿命长、节能环保等优点.一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+I2(g)?WI2(g). 所表示的原子是
所表示的原子是