题目内容
下列物质中,由极性键构成的非极性分子是( )
| A、氯仿 | B、干冰 | C、石炭酸 | D、白磷 |
考点:极性分子和非极性分子,极性键和非极性键
专题:
分析:根据由同种原子构成的共价键是非极性键,不同原子构成的共价键是极性键,分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样的分子为极性分子,以极性键结合的双原子一定为极性分子,以极性键结合的多原子分子如结构对称,正负电荷的重心重合,电荷分布均匀,则为非极性分子.
解答:
解:A、氯仿是极性键形成的极性分子,故A错误;
B、干冰是直线型,分子对称,是极性键形成的非极性分子,故B正确;
C、石炭酸是非极性键形成的非极性分子,故C错误;
D、白磷是下正四面体结构,非极键形成的非极性分子,故D错误;
故选B.
B、干冰是直线型,分子对称,是极性键形成的非极性分子,故B正确;
C、石炭酸是非极性键形成的非极性分子,故C错误;
D、白磷是下正四面体结构,非极键形成的非极性分子,故D错误;
故选B.
点评:本题主要考查了共价键与分子极性的关系,难度不大,注意非极性分子的结构对称,正负电荷中心重合来解答.

练习册系列答案
相关题目
115°C时,两种气态烃以任意比例混合,1L混合烃再与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L.下列各组混合烃不符合此条件的是( )
| A、CH4和C2H4 |
| B、CH4和C3H4 |
| C、C2H4和C3H4 |
| D、C2H2和C3H6 |
根据下表(部分短周期元素的原子半径及主要化合价)信息,判断以下叙述正确的是( )
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.186 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
| A、最高价氧化物对应水化物的碱性A>C |
| B、氢化物的沸点H2D>H2E |
| C、单质与稀盐酸反应的速率A<B |
| D、C2+与A+的核外电子数相等 |
常用的电池是一个液体电解质将两个固体电极隔开.而钠-硫(Na/S8)电池正相反,它是由固体电解质将两个液体电极隔开(如图),一个由钠-β-氧化铝固体电解质做成的中心管,将内室的熔融钠(熔点98℃)和外室的熔融硫(熔点119℃)隔开,并允许Na+通过.下列有关说法不正确的是( )
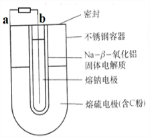

| A、a为电池的正极 |
| B、充电时b接电源的正极 |
| C、正极反应为:nS8+16ne-=8Sn2- |
| D、Na+可以穿过固体电解质和硫反应从而传递电流 |
如图是金属镁和卤素单质(X2)反应的能量变化示意图.下列说法正确的是( )

| A、由MgCl2制取Mg是放热过程 |
| B、热稳定性:MgI2>MgBr2>MgCl2>MgF2 |
| C、常温下氧化性:F2<Cl2<Br2<I2 |
| D、由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方程式为:MgBr2(s)+Cl2(g)═MgCl2(s)+Br2(g),△H=-117kJ?mol-1 |
下列粒子中,与OH-具有相同质子数和电子数的是( )
| A、Cl- |
| B、F- |
| C、NH3 |
| D、NH4+ |
现有乙酸和两种链状单烯烃混合物,其中氧的质量分数为a,则碳的质量分数是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、1.0L1.0mol/L的Na2SO4水溶液中含有的氧原子数为4NA |
| B、1molNa2O2固体中含离子总数与1molCH4中所含共价键数目相等 |
| C、1molNaClO中所有ClO-的电子总数为26NA |
| D、标准状况下,6.72LNO2与水充分反应转移的电子数目为0.1NA |
