题目内容
8.已知二氧化硅,二氧化硫和二氧化碳都是酸性氧化物,化学性质具有一定的相似性,镁和钠的化学性质也具有一定的相似性.
Ⅰ.用如上图所示装置进行镁和二氧化硫的实验,其中A是制备二氧化硫的发生装置.
(1)选择制取二氧化硫的合适试剂②③(填序号).
①10%的硫酸溶液②80%硫酸溶液③亚硫酸钠固体④亚硫酸钙固体
(2)写出装置B中发生反应的化学方程式:3Mg+SO2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+MgS(或2Mg+SO2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+S,Mg+S$\frac{\underline{\;\;△\;\;}}{\;}$MgS).
装置C中氢氧化钠溶液的作用是吸收过量二氧化硫,防止污染环境.
(3)请在图中画出制备二氧化硫的发生装置,注明仪器名称,固定仪器省略不画.
(4)你认为该装置的不足之处是在A和B之间没有连接一个干燥装置、C装置未与大气相通、在镁下方未垫一个不锈钢片、镁与玻璃管反应、未设计一个防倒吸装置(任写2条).
Ⅱ.某研究性学习小组进行了“实验室制硅”的研究,查阅资料知:①工业上在高温时用碳还原二氧化硅可制得硅;②镁在点燃的条件下即可与二氧化硅反应;③金属硅化物与稀硫酸反应生成硫酸盐与四氢化硅;④四氢化硅在空气中自燃.
他们在实验报告中记录着:“…选用合适的物质在适宜的条件下充分反应,再用足量稀硫酸溶解固体产物;然后过滤,洗涤,干燥,最后称量…在用稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的63%左右.”
(5)该小组“实验室制硅”的化学方程式是2Mg+SiO2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+Si.
(6)你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花:的原因是金属镁与生成的硅继续反应生成硅化镁,硅化镁与稀硫酸反应生成的SiH4可自燃.
分析 Ⅰ.(1)依据强酸制备弱酸的原理,结和物质的性质,选择实验室制备SO2的试剂;
(2)根据Mg与CO2的反应知Mg与SO2反应能生成氧化镁与单质硫,但单质硫能与镁反应生成硫化镁;二氧化硫有毒,不能直接排放到空气中,可用氢氧化钠吸收过量的二氧化硫;(3)依据反应物状态及反应条件选择合适的发生装置;
(4)该装置中:①A中的水蒸气会进入B与Mg反应,在A、B中间应加干燥装置;②Mg能与SiO2反应,在Mg下方垫一不锈钢片,隔离Mg和SiO2;③尾气处理装置C试管用胶塞封闭,且无防倒吸装置;
Ⅱ.(5)类似于镁和二氧化碳的反应,可生成单质硅和氧化镁;
(6)发现有爆鸣声和火花,说明生成气体,应为SiH4.
解答 解:Ⅰ.(1)制取SO2应用浓H2SO4和亚硫酸盐,选项中不可选用CaSO3,因为CaSO3微溶于水,会附在固体表面,阻碍反应进行,
故答案为:②③;
(2)Mg具有还原性,SO2具有氧化性,两者发生氧化还原反应,反应的方程式为3Mg+SO2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+MgS(或2Mg+SO2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+S,Mg+S$\frac{\underline{\;\;△\;\;}}{\;}$MgS),二氧化硫可与碱反应,易防止污染空气,
故答案为:3Mg+SO2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+MgS(或2Mg+SO2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+S,Mg+S$\frac{\underline{\;\;△\;\;}}{\;}$MgS);吸收过量二氧化硫,防止污染环境;
(3)实验室制备二氧化硫的反应为固液不加热制取气体的反应,故可用分液漏斗盛80%的H2SO4,用锥形瓶装固体Na2SO3,装置图为 ,
,
故答案为: ;
;
(4)该装置中:①A中的水蒸气会进入B与Mg反应,在A、B中间应加干燥装置;②Mg能与SiO2反应,在Mg下方垫一不锈钢片,隔离Mg和SiO2;③尾气处理装置C试管用胶塞封闭,且无防倒吸装置,
故答案为:在A和B之间没有连接一个干燥装置、C装置未与大气相通、在镁下方未垫一个不锈钢片、镁与玻璃管反应、未设计一个防倒吸装置;
Ⅱ.(5)Mg在点燃的条件下即可与SiO2反应,由题给信息可知类似于镁和二氧化碳的反应,可生成单质硅和氧化镁,反应的方程式为2Mg+SiO2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+Si,
故答案为:2Mg+SiO2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+Si;
(6)发现有爆鸣声和火花,说明生成气体,应为SiH4,原因是发生2Mg+Si$\frac{\underline{\;\;△\;\;}}{\;}$Mg2Si,Mg2Si+2H2SO4═2MgSO4+SiH4↑,SiH4+2O2═SiO2+2H2O,金属镁与生成的硅继续反应生成硅化镁,硅化镁与稀硫酸反应生成的SiH4可自燃,
故答案为:金属镁与生成的硅继续反应生成硅化镁,硅化镁与稀硫酸反应生成的SiH4可自燃.
点评 本题为信息题,以镁和二氧化硅的反应为载体考查了二氧化硫的实验室制备及性质检验,侧重培养学生分析问题解决问题的能力,题目难度中等.

| A. | B与A只能组成BA3化合物 | |
| B. | C、D、E形成的化合物与稀硫酸可能发生氧化还原反应 | |
| C. | A、B、C形成的化合物一定不能发生水解 | |
| D. | E的氧化物对应的水化物一定有强的氧化性 |
| A. | 能发生脂化反应的酸一定是羧酸 | |
| B. | 蛋白质溶液中加入浓Na2SO4溶液,蛋白质从溶液中凝聚而析出叫盐析 | |
| C. | 天然蛋白质一定条件下水解的最终产物是α-氨基酸 | |
| D. | 淀粉、纤维素和油脂在一定条件下都能发生水解反应 |
| A. | X、Y、Z在周期表中不可能处于同一周期 | |
| B. | 原子序数Y>X>Z | |
| C. | 简单离子半径:r(X2-)>r(Y+) | |
| D. | Y 单质在X单质中点燃生成物离子个数之比为1:1 |
| A. | 鸡屎矾中含有极性共价键 | |
| B. | 铜盐溶液可与铁发生置换反应 | |
| C. | 碱式碳酸铜不稳定,受热易分解 | |
| D. | 鸡屎矾投苦酒中发生的是氧化还原反应 |
| Y | ||||
| Q | W | X | Z |
(1)Y的原子结构示意图为
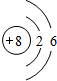 ;举一例说明Z的非金属性比X的非金属性强的事实:酸性强弱;HClO4>H3PO4,或稳定性:HCl>PH3.
;举一例说明Z的非金属性比X的非金属性强的事实:酸性强弱;HClO4>H3PO4,或稳定性:HCl>PH3.(2)W、X、Y的原子半径由大到小依次是(填元素符号)r(Si)>r(P)>r(O);W与Z形成的化合物电子式为
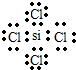 .
.(3)将Z的单质通入到含等物质的量FeBr2溶液中充分反应的离子方程式为2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-.
(4)已知:2Na(s)+1/2Y2(g)=Na2Y(s)△H=-414kJ/mol;2Na(s)+Y2(g)═Na2Y2(s)△H=-511kJ/mol;则Na2Y(s) 转变为Na2Y2(s)的反应一定条件下能自发进行的理由是Na2O(s)+$\frac{1}{2}$O2(g)=Na2O2(s)△H=-97 kJ/mol,而△S<0,△H-T△S在低温下小于0,可自发进行.
将0.2mol Na2Y2加入到100mL1mol/L QZ3中,充分反应的化学方程式为2Na2O2+AlCl3=NaAlO2+3NaCl+O2↑.
(5)R与W同周期,已知:在T℃时Ksp[R(OH)2]的值为4.0×l0-12,则R(OH)2饱和溶液中c(OH-)=2.0×l0-4 mol•L-1.
| A. | 4.6 g乙醇中含有的C-H键的个数为0.6NA | |
| B. | 34 g H2O2中含有的阴离子数为NA | |
| C. | 标准状况下,V L水含有的氧原子个数约为$\frac{V}{22.4}$NA | |
| D. | 1 mol Fe2+与足量的H2O2溶液反应,转移NA个电子 |
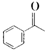 的化学式为C8H8O,该有机物核磁共振氢谱有4种吸收峰,该分子共平面的碳原子至少有7个.
的化学式为C8H8O,该有机物核磁共振氢谱有4种吸收峰,该分子共平面的碳原子至少有7个. 、
、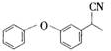 .
.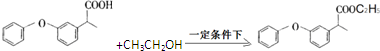 .
.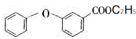 .
.