题目内容
8.在给定条件下,下列选项中所示的物质间转化能够一步实现的是( )| A. | NH3$→_{催化剂△}^{O_{2}}$NO2$\stackrel{H_{2}O_{2}(aq)}{→}$HNO3 | |
| B. | 含2molHCl的浓盐酸$→_{△}^{总量MnO_{2}}$0.5molCl2$\stackrel{石灰石}{→}$0.25molCa(ClO)2 | |
| C. | 饱和NaCl溶液$\stackrel{NH_{3}.CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| D. | 海水$\stackrel{熟石灰}{→}$Mg(OH)2$\stackrel{稀盐酸}{→}$MgCl2(aq)$\stackrel{通电}{→}$Mg |
分析 A.氨气催化氧化生成一氧化氮;
B.二氧化锰只能与浓盐酸反应,与稀盐酸不反应;
C.依据侯氏制碱原理解答;
D.电解氯化镁溶液 生成氢氧化镁、氢气和氯气.
解答 解:A.氨气催化氧化生成一氧化氮,所以不能一步实现氨气到二氧化氮的转化,故A错误;
B.含2molHCl的浓盐酸,如果能完全反应则生成氯气物质的量为0.5mol,但是随着反应进行浓盐酸浓度降低变为稀盐酸,稀盐酸不与二氧化锰反应,所以生成氯气的量小于0.5mol,故B错误;
C.侯氏制碱法原理为:向饱和食盐水中通入氨气再通入二氧化碳即可生成碳酸氢钠固体,碳酸氢钠受热分解即可得到碳酸钠,所以该过程能一步实现,故C正确;
D.电解氯化镁溶液 生成氢氧化镁、氢气和氯气,最后一步不能实现,应改为电解熔融的氯化镁,故D错误;
故选:C.
点评 本题考查了常见物质性质和反应产物的分析判断,主要是氮、镁、钠及其化合物性质的理解应用,掌握基础是解题关键,题目难度中等,注意侯氏制碱法原理.

练习册系列答案
相关题目
3.已知5KCl+KClO3+3H2SO4═3Cl2↑+3K2SO4+3H2O,下列说法不正确的是( )
| A. | H2SO4既不是氧化剂又不是还原剂 | |
| B. | 1molKClO3参加反应时有5mol电子转移 | |
| C. | KClO3是氧化剂 | |
| D. | 被氧化与被还原的氯元素的质量比为1:5 |
4.能把Na2SO4、NH4NO3、KCl、(NH4)2SO4四瓶溶液加以区别的一种试剂是( )
| A. | Ba(OH)2 | B. | BaCl2 | C. | Ba(NO3)2 | D. | NaOH |
1.下列离子方程式中书写正确的是( )
| A. | 氢氧化钡溶液与稀硫酸混合:Ba2++SO42-→BaSO4↓ | |
| B. | 铁粉溶于稀硫酸中:2Fe+6H+→2Fe3++3H2↑ | |
| C. | 氨水与盐酸混合:OH-+H+→H2O | |
| D. | 硫化钠溶液中滴加硝酸银:S2-+2Ag+→Ag2S↓ |
3.化学与生活密切相关,下列物质的化学性质与其实际应用相对应的是( )
| 选项 | 化学性质 | 实际应用 |
| A | Na、K均是活泼金属 | 钠钾合金用作原子反应堆导热剂 |
| B | H2O2能使蛋白质变性 | 医疗上用于伤口消毒 |
| C | CH2=CH2能与H2O发生加成反应 | 乙烯用作果实的催熟剂 |
| D | NH3具有还原性 | 作食品加工的制冷剂 |
| A. | A | B. | B | C. | C | D. | D |
13.现有25mL 2mol•L-1的Na2CO3溶液和75mL 1mol•L-1的稀盐酸.①将Na2CO3溶液逐滴滴加到盐酸中;②将盐酸逐滴滴加到Na2CO3溶液中.在标准状况下生成气体的情况是( )
| A. | 均为0.84 L | B. | 均为0.56 L | C. | ①>② | D. | ①<② |
17.能表示质量数是37的阴离子是( )
| A. | 19个质子,18个中子,19个电子 | B. | 18个质子,19个中子,18个电子 | ||
| C. | 19个质子,18个中子,18个电子 | D. | 17个质子,20个中子,18个电子 |
18.设NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 23gNO2和N2O4的混合气体中含原子总数为1.5NA | |
| B. | 31g白磷P4(如图)中所含的P-P键的个数为0.25NA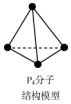 | |
| C. | 足量的Cu与100mL18.4mol/L的浓硫酸反应,失去3.68NA个电子 | |
| D. | 浓度均为2.0mol/L的盐酸和醋酸溶液各100mL,其含氢离子均为0.2NA |
