题目内容
下列反应的离子方程式中正确的是( )
| A、铁与盐酸的反应:2Fe+6H+=2Fe3++3H2↑ |
| B、石灰石与稀盐酸反应制备二氧化碳:CO32-+2H+=H2O+CO2↑ |
| C、向氢氧化铜中滴加硫酸溶液:H++OH-=H2O |
| D、硫酸铜溶液和氢氧化钡溶液混合:Cu2++SO42-+Ba2++2OH-=Cu(OH)2↓+BaSO4↓ |
考点:离子方程式的书写
专题:离子反应专题
分析:A.盐酸具有弱氧化性,只能将铁氧化为亚铁离子;
B.石灰石难溶于水,写化学式;
C.氢氧化铜难溶于水写化学式;
D.二者反应生成沉淀氢氧化铜和硫酸钡.
B.石灰石难溶于水,写化学式;
C.氢氧化铜难溶于水写化学式;
D.二者反应生成沉淀氢氧化铜和硫酸钡.
解答:
解:A.盐酸具有弱氧化性,只能将铁氧化为亚铁离子,离子方程式为Fe+2H+=Fe2++H2↑,故A错误;
B.石灰石难溶于水,写化学式,离子方程式为CaCO3+2H+=H2O+CO2↑+Ca2+,故B错误;
C.氢氧化铜难溶于水写化学式,离子方程式为Cu(OH)2+2H+=Cu2++2H2O,故C错误;
D.二者反应生成沉淀氢氧化铜和硫酸钡,离子方程式为Cu2++SO42-+Ba2++2OH-=Cu(OH)2↓+BaSO4↓,故D正确;
故选D.
B.石灰石难溶于水,写化学式,离子方程式为CaCO3+2H+=H2O+CO2↑+Ca2+,故B错误;
C.氢氧化铜难溶于水写化学式,离子方程式为Cu(OH)2+2H+=Cu2++2H2O,故C错误;
D.二者反应生成沉淀氢氧化铜和硫酸钡,离子方程式为Cu2++SO42-+Ba2++2OH-=Cu(OH)2↓+BaSO4↓,故D正确;
故选D.
点评:本题考查离子方程式的书写,明确物质性质及离子方程式书写规则即可解答,单质、气体、沉淀、弱电解质、氧化物、络合物都写化学式,注意要遵循客观事实、原子守恒、电荷守恒、转移电子守恒,题目难度中等,易错选项是A.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、25°C时,1L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA |
| B、标准状况下,1molCF4中含有的电子对数目为4.0NA |
| C、1L 0.5mol?L-1 的H2SO3溶液中含有的H+数目为NA |
| D、一定条件下1molN2与3molH2混合充分反应后生成NH3分子数小于2.0NA |
设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、等质量的N2和CO所含分子数均为NA |
| B、常温常压下,1.06 g Na2CO3含有的Na+离子数为0.2NA |
| C、2.4 g金属镁变为镁离子时失去的电子数为0.1NA |
| D、常温常压下48gO2和48gO3含有的氧原子数均为3NA |
关于氢键,下列说法正确的是( )
| A、含氢元素的化合物中一定有氢键 |
B、因为分子间存在氢键的缘故,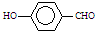 比 比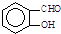 熔沸点高 熔沸点高 |
| C、由于氢键比范德华力强,所以H2O分子比H2S分子稳定 |
| D、“可燃冰”--甲烷水合物(例如:8CH4?46H2O)中CH4与H2O之间存在氢键 |
下列有关工业生产的叙述正确的是( )
| A、合成氨生产过程中升高温度可加快反应速率,缩短生产周期,故温度越高越好 |
| B、硫酸工业中,使用催化剂是为了提高SO2转化为SO3的转化率 |
| C、电解精炼铜时,精铜作阴极 |
| D、电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室 |