题目内容
11.已知高温条件下2Al+Fe2O3═2Fe+Al2O3放出大量的热,可用于定向爆破和焊接铁轨.(1)该反应中Al元素被氧化.
(2)标出该反应的电子转移方向和数目
 .
.(3)欲除去产物中的Al2O3,所加试剂是NaOH溶液,该反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
分析 应2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3中,Al元素化合价升高,由0价升高为+3价,Fe元素化合价降低,由+3价降低到0价,以此解答该题.
解答 解:(1)Al元素化合价升高,被氧化,故答案为:Al;
(2)Al元素化合价升高,由0价升高为+3价,Fe元素化合价降低,由+3价降低到0价,电子转移方向和数目可表示为 ,
,
故答案为: ;
;
(3)为两性氧化物,可与氢氧化钠溶液反应,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,故答案为:NaOH溶液;Al2O3+2OH-=2AlO2-+H2O.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应中基本概念,题目难度不大.

练习册系列答案
相关题目
1.下列说法正确的是( )
| A. | 1molO2与金属Na反应,O2一定得到4NA个电子 | |
| B. | 18g NH4+中所含的电子数为11NA | |
| C. | 1molFe与足量的Cl2反应,转移的电子数为2NA | |
| D. | 1molCl2与足量的Fe反应,转移的电子数为2NA |
2.在固定体积的密闭容器中进行如下反应:2SO2(g)+O2(g)?2SO3(g).已知反应过程某一时刻SO2、O2、SO3浓度(mol•L-1)分别为0.2、0.1、0.2,达到平衡时,浓度可能正确的是( )
| A. | SO2、O2分别为0.4mol•L-1、0.2mol•L-1 | |
| B. | SO2为0.25mol•L-1 | |
| C. | SO2、SO3均为0.15mol•L-1 | |
| D. | SO3为0.4mol•L-1 |
19.下列用来表示物质变化的表述和化学用语中,正确的是( )
| A. | 用铁做阳极材料电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-═Cl2↑ | |
| B. | 碱性甲烷燃料电池的负极反应式:CH3OH-6e-+6OH-═CO2+5H2O | |
| C. | 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-═Cu2+ | |
| D. | 钢铁发生电化学腐蚀的负极反应式:Fe-2e-→Fe2+ |
6.常温下,下列各组物质不能用一种试剂通过化学反应鉴别的是( )
| A. | FeCl2 MgCl2 AlCl3 | B. | AgNO3KNO3 Na2CO3 | ||
| C. | NH4Cl (NH4)2SO4 K2SO4 | D. | Na2CO3 NaHCO3K2CO3 |
3.下列实验操作中正确的是( )
| A. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| B. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| C. | 分液操作时,上层液体从下口放出 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
20.下列关于胶体和溶液的叙述正确的是( )
| A. | 溶液中溶质微粒一定不带电,胶体中分解质微粒带有电荷 | |
| B. | 溶液呈电中性,胶体带电荷 | |
| C. | 胶体是比溶液更稳定的分散系 | |
| D. | 胶体是一种较稳定的分散系 |
5.研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.
(1)CO可用于炼铁,
已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
C(s)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol.
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液).写出该电池的正极反应式:O2+4e-+2H2O=4OH-.
(3)CO2和H2充人一定体积的密闭容器中,在两种温度下发生反应:
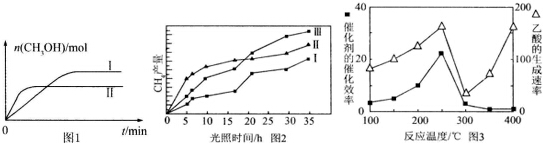
CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CH3OH的物质的量随时间的变化见图1.
①线Ⅰ、Ⅱ对应的平衡常数大小关系为KI>KⅡ (填“>”或“=”或“<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为0.4<n(c)≤1mol.
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,在不同催化
剂(Ⅰ、Ⅱ,Ⅲ)作用下,CH4产量随光照时间的变化见图2.在O~15小时内,CH4的平均生成速率Ⅰ、Ⅱ和Ⅲ从大到小的顺序为II>III>I(填序号).
(5)以TiO2/Cu2Al2O4 为催化剂,可以将CO2和CH4直接转化成乙酸.在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图3.
①乙酸的生成速率主要取决于温度影响的范围是300℃~400℃.
②Cu2Al2O4可溶于稀硝酸,写出有关的离子方程式:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.

(1)CO可用于炼铁,
已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
C(s)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol.
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液).写出该电池的正极反应式:O2+4e-+2H2O=4OH-.
(3)CO2和H2充人一定体积的密闭容器中,在两种温度下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CH3OH的物质的量随时间的变化见图1.
①线Ⅰ、Ⅱ对应的平衡常数大小关系为KI>KⅡ (填“>”或“=”或“<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2、3mol H2 | a mol CO2、b mol H2、 c mol CH3OH(g)、c molH2O(g) |
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,在不同催化
剂(Ⅰ、Ⅱ,Ⅲ)作用下,CH4产量随光照时间的变化见图2.在O~15小时内,CH4的平均生成速率Ⅰ、Ⅱ和Ⅲ从大到小的顺序为II>III>I(填序号).
(5)以TiO2/Cu2Al2O4 为催化剂,可以将CO2和CH4直接转化成乙酸.在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图3.
①乙酸的生成速率主要取决于温度影响的范围是300℃~400℃.
②Cu2Al2O4可溶于稀硝酸,写出有关的离子方程式:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
