题目内容
10.100mL0.1mol•L-1醋酸与50mL0.2mol•L-1NaOH溶液混合,在所得溶液中( )| A. | c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | B. | c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | ||
| C. | c(Na+)>c(CH3COO-)>c(H+)=c(OH-) | D. | c(Na+)=c(CH3COO-)>c(OH-)>c(H+) |
分析 100mL0.1mol•L-1醋酸与50mL0.2mol•L-1NaOH物质的量相等,二者恰好完全反应生成CH3COONa,CH3COONa是强碱弱酸盐,醋酸根离子水解导致溶液呈碱性,但其水解沉淀较小,结合电荷守恒分析解答.
解答 解:100mL0.1mol•L-1醋酸与50mL0.2mol•L-1NaOH物质的量相等,二者恰好完全反应生成CH3COONa,CH3COONa是强碱弱酸盐,醋酸根离子水解导致溶液呈碱性,则存在c(OH-)>c(H+),溶液中存在电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以得c(Na+)>c(CH3COO-),醋酸根离子水解沉淀较小,所以存在c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故选A.
点评 本题考查离子浓度大小比较,为高频考点,侧重考查学生分析判断能力,明确溶液中溶质成分及其性质是解本题关键,知道常见盐的类型及溶液酸碱性判断方法,题目难度不大.

练习册系列答案
相关题目
20.不能使化学反应:CO(g)+NO2(g)=CO(g)+N2(g)速率增大的措施是( )
| A. | 增加CO的量 | B. | 增大压强 | C. | 升高温度 | D. | 加入稀有气体 |
1.镁、锂在元素周期表中具有特殊“对角线”位置关系,它们的性质相似,例如它们的单质在过量氧气中燃烧时均只生成正常的氧化物,以下对锂的性质的叙述正确的是( )
| A. | Li2SO4难溶于水 | B. | Li遇浓硫酸产生“钝化”现象 | ||
| C. | LiOH的水溶液不能使酚酞变红 | D. | Li2CO3受热分解,生成Li2O和CO2 |
18.某周期ⅡA族元素的原子序数为 x,则同周期的第ⅢA族元素的原子序数是( )
| A. | 只有 x+1 | B. | 可能是 x+8或 x+18 | ||
| C. | 可能是 x+2 | D. | 可能是 x+1或 x+11或x+25 |
5.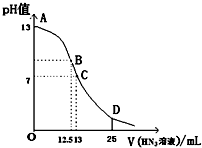 纯的叠氮酸(HN3)是无色液体,常用做引爆剂,常温下向25mL 0.1mol•L-1NaOH溶液中加入0.2mol•L-1HN3的溶液,滴加过程中的pH值的变化曲线(溶液混合时的体积变化忽略不计)如图.下列说法正确的是( )
纯的叠氮酸(HN3)是无色液体,常用做引爆剂,常温下向25mL 0.1mol•L-1NaOH溶液中加入0.2mol•L-1HN3的溶液,滴加过程中的pH值的变化曲线(溶液混合时的体积变化忽略不计)如图.下列说法正确的是( )
 纯的叠氮酸(HN3)是无色液体,常用做引爆剂,常温下向25mL 0.1mol•L-1NaOH溶液中加入0.2mol•L-1HN3的溶液,滴加过程中的pH值的变化曲线(溶液混合时的体积变化忽略不计)如图.下列说法正确的是( )
纯的叠氮酸(HN3)是无色液体,常用做引爆剂,常温下向25mL 0.1mol•L-1NaOH溶液中加入0.2mol•L-1HN3的溶液,滴加过程中的pH值的变化曲线(溶液混合时的体积变化忽略不计)如图.下列说法正确的是( )| A. | 若用已知浓度的NaOH溶液滴定HN3溶液来测定HN3的浓度时应用甲基橙作指示剂 | |
| B. | 常温下,向0.2mol•L-1HN3的溶液中加水稀释,则 $\frac{c({{N}_{3}}^{-})}{c(O{H}^{-})•c(H{N}_{3})}$不变 | |
| C. | 分别中和PH均为4的HN3溶液和HCl溶液,消耗0.1mol•L-1NaOH溶液的体积相同 | |
| D. | D点时溶液中离子浓度存在如下关系:c(H+)+c(HN3)=c(N3-)+c(OH-) |
15.80℃时,2L 密闭容器中充入0.40mol N2O4,发生反应N2O4?2NO2 △H=+53kJ/mol,获得如表数据,下列判断正确的是( )
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| c(NO2)/mol•L-1 | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
| A. | 升高温度该反应的平衡常数K减小 | |
| B. | 该反应的△S<0 | |
| C. | 反应达平衡时吸热15.9kJ | |
| D. | 100s 时再通入0.40 mol N2O4,达新平衡时N2O4的转化率减小 |
1. 化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.
化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.
Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率.(已知:S2O32-+2H+═H2O+S↓+SO2↑)
(1)除如图装置所示的实验用品外,还需要的一件实验用品是秒表.
(2)若在2min时收集到224mL(已折算成标准状况)气体,可计算出该2min内H+的反应速率,而该测定值比实际值偏小,其原因是SO2会部分溶于水.
(3)利用该化学反应,试简述测定反应速率的其他方法:测定一段时间内生成硫沉淀的质量(或实时测定溶液中氢离子浓度)(写一种).
Ⅱ.探究化学反应速率的影响因素
为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表.
(已知 I2+2S2O32-═S4O62-+2I-,其中Na2S2O3溶液均足量)
(4)表中Vx=4mL,t1、t2、t3的大小关系是t1<t2<t3.
 化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.
化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率.(已知:S2O32-+2H+═H2O+S↓+SO2↑)
(1)除如图装置所示的实验用品外,还需要的一件实验用品是秒表.
(2)若在2min时收集到224mL(已折算成标准状况)气体,可计算出该2min内H+的反应速率,而该测定值比实际值偏小,其原因是SO2会部分溶于水.
(3)利用该化学反应,试简述测定反应速率的其他方法:测定一段时间内生成硫沉淀的质量(或实时测定溶液中氢离子浓度)(写一种).
Ⅱ.探究化学反应速率的影响因素
为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表.
(已知 I2+2S2O32-═S4O62-+2I-,其中Na2S2O3溶液均足量)
| 实验序号 | 体积V/mL | 时间/s | |||
| Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
| ① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
| ② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
| ③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
 .
.