题目内容
1.镁、锂在元素周期表中具有特殊“对角线”位置关系,它们的性质相似,例如它们的单质在过量氧气中燃烧时均只生成正常的氧化物,以下对锂的性质的叙述正确的是( )| A. | Li2SO4难溶于水 | B. | Li遇浓硫酸产生“钝化”现象 | ||
| C. | LiOH的水溶液不能使酚酞变红 | D. | Li2CO3受热分解,生成Li2O和CO2 |
分析 根据金属镁和化合物的性质知识来确定金属锂以及其化合物的性质.
解答 解:A、硫酸镁易溶于水,所以硫酸锂是易溶于水的,故A错误;
B、金属镁与浓硫酸不发生钝化现象,所以锂遇浓硫酸不发生钝化,故B错误;
C、氢氧化锂是可溶于水的碱,电离产生氢氧根离子,溶液呈碱性,所以LiOH的水溶液也能使酚酞变红,故C错误;
D、碳酸镁受热分解生成氧化镁和二氧化碳,所以推知碳酸锂受热分解,生成Li2O和CO2,故D正确.
故选D.
点评 本题考查学生元素周期律的应用知识,难度不大.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
11.下列化合物中,既能发生消去反应生成烯烃,又能发生水解反应的是( )
| A. | CH3Cl | B. |  | C. |  | D. |  |
12.分子式为C5H10O并能与新制的Cu(OH)2浊液反应的有机物有(不含立体异构)( )
| A. | 3种 | B. | 4种 | C. | 6种 | D. | 8种 |
16. 乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:
乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:
请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)2CH3CHO+O2$→_{60℃-80℃}^{CuO}$2CH3COOH;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在试管A 的反应液中,目的是测量反应溶液的温度;当试管A内的主要反应完成后温度计水银球的位置应在略低于试管A 的支管口处,目的是收集含乙酸的馏分
(3)烧杯B的作用是使试管A内的反应液均匀受热发生反应,烧杯B内盛装的液体可以是甘油(在题给物质中找);
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案.所提供的药品有:pH试纸、红色的石蕊试纸、白色的醋酸铅试纸、碳酸氢钠粉末.实验仪器任选.该方案为将少量碳酸氢钠粉未,放入一个洁净的试管中,加入少量试管C中的液体,若有气体产生,则说明试管C中含有产物乙酸.(或把一块pH试纸放在表面皿(或玻璃片)上,用洁净、干燥的玻璃棒蘸取试管C内的液体,点在pH试纸中部,试纸变色后,用标准比色卡比较来确定溶液的pH,进而说明是否有乙酸生成).
 乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:
乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:| 物质 | 乙醛 | 乙酸 | 甘油 | 乙醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 78.5℃ | 100℃ |
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)2CH3CHO+O2$→_{60℃-80℃}^{CuO}$2CH3COOH;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在试管A 的反应液中,目的是测量反应溶液的温度;当试管A内的主要反应完成后温度计水银球的位置应在略低于试管A 的支管口处,目的是收集含乙酸的馏分
(3)烧杯B的作用是使试管A内的反应液均匀受热发生反应,烧杯B内盛装的液体可以是甘油(在题给物质中找);
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案.所提供的药品有:pH试纸、红色的石蕊试纸、白色的醋酸铅试纸、碳酸氢钠粉末.实验仪器任选.该方案为将少量碳酸氢钠粉未,放入一个洁净的试管中,加入少量试管C中的液体,若有气体产生,则说明试管C中含有产物乙酸.(或把一块pH试纸放在表面皿(或玻璃片)上,用洁净、干燥的玻璃棒蘸取试管C内的液体,点在pH试纸中部,试纸变色后,用标准比色卡比较来确定溶液的pH,进而说明是否有乙酸生成).
6.下列选项中符合如图关系的是( )
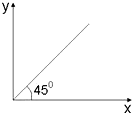

| A. | 第二周期的核电荷数和最高化合价之间的关系 | |
| B. | 烷烃中碳原子数(X)与氢原子数(Y)的关系 | |
| C. | 温度大于100℃时,CH4和C2H4的混合气体在氧气中充分燃烧,同温同压下燃烧前后参与反应的气体的体积之和(X)与生成物的气体体积之和(Y)的关系 | |
| D. | 燃烧一定质量C2H4与C3H6的混合气体,消耗O2的物质的量(Y)与C3H6的质量分数(X)的关系 |
13.当光束通过下列分散系时,能观察到丁达尔效应的是( )
| A. | Mg(OH)2悬浊液 | B. | 稀盐酸 | C. | K2SO4溶液 | D. | Fe(OH)3胶体 |
10.100mL0.1mol•L-1醋酸与50mL0.2mol•L-1NaOH溶液混合,在所得溶液中( )
| A. | c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | B. | c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | ||
| C. | c(Na+)>c(CH3COO-)>c(H+)=c(OH-) | D. | c(Na+)=c(CH3COO-)>c(OH-)>c(H+) |
13.已知:将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生.若再加入双氧水,将发生反应:H2O2+2H++2I-→2H2O+I2,且生成的I2立即与试剂X反应而被消耗.一段时间后,试剂X将被反应生成的I2完全消耗.由于溶液中的I-继续被H2O2氧化,生成的I2与淀粉作用,溶液立即变蓝.因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算反应H2O2+2H++2I-→2H2O+I2的反应速率.
下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条 件下进行):
件下进行):
(1)已知:实验1、2的目的是探究H2O2浓度对H2O2+2H++2I-→2H2O+I2反应速率的影响.实验2中m=20.0,n=20.0.
(2)已知,I2与X反应时,两者物质的量之比为1:2.按面表格中的X和KI的加入量,加入V(H2O2)>0.5mL,才确保看到蓝色.
(3)实验1,浓度c(X)~t的变化曲线如图,若保持其它条件不变,请在答题卡坐标图中,分别画出实验3、实验4,c(X)~t的变化曲线图(进行相应的标注).
(4)实验3表明:硫酸铁能提高反应速率.催化剂能加快反应速率是因为催化剂降低(填“提高”或“降低”)了反应活化能.
(5)环境友好型铝-碘电池已研制成功,已知电池总反应为:2Al(s)+3I2(s)$?_{充电}^{放电}$2AlI3(s).含I-传导有机晶体合成物作为电解质,该电池负极的电极反应为:Al-3e-+3I-=AlI3,充电时Al连接电源的负极.
下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条
 件下进行):
件下进行):| 编号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 开始变蓝时间(min) | ||||
| 0.1 mol•Lˉ1 KI溶液 | H2O | 0.01 mol•Lˉ1 X 溶液 | 0.1 mol•Lˉ1 双氧水 | 1 mol•Lˉ1 稀盐酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
| 4 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
(2)已知,I2与X反应时,两者物质的量之比为1:2.按面表格中的X和KI的加入量,加入V(H2O2)>0.5mL,才确保看到蓝色.
(3)实验1,浓度c(X)~t的变化曲线如图,若保持其它条件不变,请在答题卡坐标图中,分别画出实验3、实验4,c(X)~t的变化曲线图(进行相应的标注).
(4)实验3表明:硫酸铁能提高反应速率.催化剂能加快反应速率是因为催化剂降低(填“提高”或“降低”)了反应活化能.
(5)环境友好型铝-碘电池已研制成功,已知电池总反应为:2Al(s)+3I2(s)$?_{充电}^{放电}$2AlI3(s).含I-传导有机晶体合成物作为电解质,该电池负极的电极反应为:Al-3e-+3I-=AlI3,充电时Al连接电源的负极.
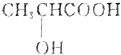 )有一对手性异构体,因为其分子中含有一个手性碳原子.
)有一对手性异构体,因为其分子中含有一个手性碳原子.