题目内容
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应).某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究.
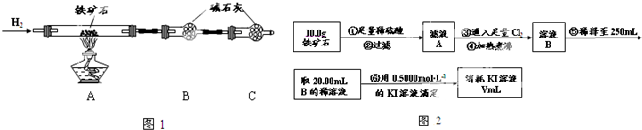
Ⅰ.铁矿石中含氧量的测定
①按图1组装仪器,检查装置的气密性;
②将5.0g铁矿石放入硬质玻璃管中,装置B、C中的药品如图1所示(夹持仪器均省略);
③从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯
④充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却.
(1)装置C的作用为 .
(2)测的反应后装置B增重1.35g,则铁矿石中氧的百分含量为 .
Ⅱ.铁矿石中含铁量的测定
(1)步骤④中煮沸的作用是 .
(2)步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、 .
(3)下列有关步骤⑥的操作中说法正确的是 .
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂 c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不需要用待测液润洗 e.滴定过程中,眼睛注视滴定管中液面变化
f.滴定结束后,30s内溶液不恢复原来的颜色再读数
(4)若滴定过程中消耗0.5000mol?L-1 KI溶液20.00mL,则铁矿石中铁的百分含量为 .
Ⅲ.由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为 .

Ⅰ.铁矿石中含氧量的测定
①按图1组装仪器,检查装置的气密性;
②将5.0g铁矿石放入硬质玻璃管中,装置B、C中的药品如图1所示(夹持仪器均省略);
③从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯
④充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却.
(1)装置C的作用为
(2)测的反应后装置B增重1.35g,则铁矿石中氧的百分含量为
Ⅱ.铁矿石中含铁量的测定
(1)步骤④中煮沸的作用是
(2)步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、
(3)下列有关步骤⑥的操作中说法正确的是
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂 c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不需要用待测液润洗 e.滴定过程中,眼睛注视滴定管中液面变化
f.滴定结束后,30s内溶液不恢复原来的颜色再读数
(4)若滴定过程中消耗0.5000mol?L-1 KI溶液20.00mL,则铁矿石中铁的百分含量为
Ⅲ.由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:Ⅰ、(1)B中的碱石灰是吸收置换反应生成的水的,为了防止空气成分对实验的影响,要加一个装置吸收空气中的水以及二氧化碳;
(2)反应后装置B增重1.35g,即氢气和氧化铁反应后生成的水的质量,可以根据氧守恒来计算;
Ⅱ、铁矿石先用足量的稀硫酸溶解,过滤除去杂质,得到只含铁的离子的溶液,再通氯气将溶液中的铁的离子氧化成三价铁离子,再用碘化钾来滴定,据此分析计算;
(1)煮沸可以将水中的气体赶跑;
(2)根据稀释液体和配制一定体积的溶液所选择的仪器来回答;
(3)根据滴定试验以及滴定过程中的实验误差分析知识来回答判断;
(4)根据元素守恒和化学反应方程式进行计算;
Ⅲ.Ⅰ中装置B增重1.35g为生成水的质量,根据氧元素守恒5g矿石中计算n(O),Ⅱ中步骤⑥发生2Fe3++2I-=2Fe2++I2,根据消耗KI溶液体积计算n(Fe3+),根据Fe元素守恒计算10g矿石中n(Fe),据此确定氧化物化学式.
(2)反应后装置B增重1.35g,即氢气和氧化铁反应后生成的水的质量,可以根据氧守恒来计算;
Ⅱ、铁矿石先用足量的稀硫酸溶解,过滤除去杂质,得到只含铁的离子的溶液,再通氯气将溶液中的铁的离子氧化成三价铁离子,再用碘化钾来滴定,据此分析计算;
(1)煮沸可以将水中的气体赶跑;
(2)根据稀释液体和配制一定体积的溶液所选择的仪器来回答;
(3)根据滴定试验以及滴定过程中的实验误差分析知识来回答判断;
(4)根据元素守恒和化学反应方程式进行计算;
Ⅲ.Ⅰ中装置B增重1.35g为生成水的质量,根据氧元素守恒5g矿石中计算n(O),Ⅱ中步骤⑥发生2Fe3++2I-=2Fe2++I2,根据消耗KI溶液体积计算n(Fe3+),根据Fe元素守恒计算10g矿石中n(Fe),据此确定氧化物化学式.
解答:
解:Ⅰ.(1)该实验中,氢气和氧化铁反应生成金属铁和水,根据固体质量的变化来计算铁的含量,B处的干燥管作用是吸收产生的水蒸气,所以C装置要防止防止空气中的水蒸气和CO2进入B中,影响测定结果,故答案为:防止空气中的水蒸气和CO2进入B中,影响测定结果;
(2)测的反应后装置B增重1.35g,根据反应的实质即生成的水的质量,所以氧元素的质量分数是:
×100%=24%,故答案为:24%;
Ⅱ.铁矿石先用足量的稀硫酸溶解,过滤除去杂质,得到只含铁的离子的溶液,再通氯气将溶液中的铁的离子氧化成三价铁离子,再用碘化钾来滴定;
(1)向铁矿石中加入硫酸,化反应生成硫酸的铁盐溶液,还存在过量的硫酸溶液,加入过量的氯气,煮沸的作用是赶走溶液中溶解的过量的Cl2,故答案为:赶走溶液中溶解的过量的Cl2;
(2)容量瓶是一种定容仪器,若是稀释到250mL,则采用的仪器有:烧杯、玻璃棒、胶头滴管、250mL容量瓶,故答案为:250mL容量瓶;
(3)a.碘水为黄色,三价铁离子也是黄色溶液,滴定过程中需加指示剂,故a错误;
b.滴定过程中,三价铁可以和碘离子发生反应生成亚铁离子和碘单质,碘单质遇到淀粉溶液显示蓝色,但是亚铁离子的绿色会产生干扰作用,故b错误;
c.滴定管用蒸馏水洗涤后必须用标准液润洗,故c错误;
d.锥形瓶不需要用待测液润洗,故d正确;
e.滴定过程中,眼睛注视锥形瓶中颜色的变化,故e错误;
f.滴定结束后,30s内溶液不恢复原来的颜色再读数,故f正确.
故选df.
(4)由于所取溶液(含Fe3+)的体积与消耗KI溶液的体积相等,结合方程式可知,c(Fe3+)=c(KI)=0.5mol?L-1,所以铁元素的百分含量为:
×100%=70%,故答案为:70%;
Ⅲ.Ⅰ中装置B增重1.35g为生成水的质量,根据氧元素守恒,5g矿石中n(O)=n(H2O)=
=0.075mol,10g矿石中n(O)=0.15mol,
Ⅱ中步骤⑥发生2Fe3++2I-=2Fe2++I2,n(Fe3+)=0.02L×0.5mol/L×
=0.125mol,故10矿石中n(Fe)=n(Fe3+)=0.125mol,
故n(Fe):n(O)=0.125mol:0.15mol=5:6,即化学式为:Fe5O6,
故答案为:Fe5O6.
(2)测的反应后装置B增重1.35g,根据反应的实质即生成的水的质量,所以氧元素的质量分数是:
| ||
| 5.0 |
Ⅱ.铁矿石先用足量的稀硫酸溶解,过滤除去杂质,得到只含铁的离子的溶液,再通氯气将溶液中的铁的离子氧化成三价铁离子,再用碘化钾来滴定;
(1)向铁矿石中加入硫酸,化反应生成硫酸的铁盐溶液,还存在过量的硫酸溶液,加入过量的氯气,煮沸的作用是赶走溶液中溶解的过量的Cl2,故答案为:赶走溶液中溶解的过量的Cl2;
(2)容量瓶是一种定容仪器,若是稀释到250mL,则采用的仪器有:烧杯、玻璃棒、胶头滴管、250mL容量瓶,故答案为:250mL容量瓶;
(3)a.碘水为黄色,三价铁离子也是黄色溶液,滴定过程中需加指示剂,故a错误;
b.滴定过程中,三价铁可以和碘离子发生反应生成亚铁离子和碘单质,碘单质遇到淀粉溶液显示蓝色,但是亚铁离子的绿色会产生干扰作用,故b错误;
c.滴定管用蒸馏水洗涤后必须用标准液润洗,故c错误;
d.锥形瓶不需要用待测液润洗,故d正确;
e.滴定过程中,眼睛注视锥形瓶中颜色的变化,故e错误;
f.滴定结束后,30s内溶液不恢复原来的颜色再读数,故f正确.
故选df.
(4)由于所取溶液(含Fe3+)的体积与消耗KI溶液的体积相等,结合方程式可知,c(Fe3+)=c(KI)=0.5mol?L-1,所以铁元素的百分含量为:
| 0.5mol/L×0.25L×56g/mol |
| 10g |
Ⅲ.Ⅰ中装置B增重1.35g为生成水的质量,根据氧元素守恒,5g矿石中n(O)=n(H2O)=
| 1.35g |
| 18g/mol |
Ⅱ中步骤⑥发生2Fe3++2I-=2Fe2++I2,n(Fe3+)=0.02L×0.5mol/L×
| 250mL |
| 20mL |
故n(Fe):n(O)=0.125mol:0.15mol=5:6,即化学式为:Fe5O6,
故答案为:Fe5O6.
点评:本题是一道探究物质的组成、测量物质的含量知识的一道综合考查题,考查学生分析和解决问题的能力,综合性强,难度大.

练习册系列答案
相关题目
下列关于物质分类的说法正确的是( )
| A、化合反应均为氧化还原反应 |
| B、液氨、液氯、液体氯化氢都是非电解质 |
| C、多糖、油脂、蛋白质都是高分子化合物 |
| D、古代的陶瓷、砖瓦,现代的玻璃、水泥等,都是硅酸盐产品 |
下列说法错误的是( )
| A、两位美国科学家和一位德国科学家因研制出超分辨率荧光显微镜而共享了2014年诺贝尔化学奖 |
| B、大雾天气常造成机场封闭、飞机航班延误,气象中的雾属于胶体 |
| C、借助仪器来分析化学物质的组成是常用的手段,原子吸收光谱常用来确定物质中含有哪些非金属元素 |
| D、同位素的应用已遍及各个领域,在医疗上利用同位素的放射性治疗肿瘤 |

 )是有香味的有机化合物,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
)是有香味的有机化合物,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
 蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
蛇纹石可用于生产氢氧化镁,简要工艺流程如下: