题目内容
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g)
其化学平衡常数K和温度t的关系如下表:
(1)该反应的化学平衡常数表达式为K= ;
(2)该反应为 反应(选填吸热、放热);
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分).
a.容器中压强不变b.混合气体中c(CO)不变 c.v正(H2)=v逆(H2O)d.c(CO2)=c(CO)
(4)830℃时,向该容器中起始加入2.0molCO2和1molH2,达平衡时H2的转化率为 .
其化学平衡常数K和温度t的关系如下表:
| t | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(2)该反应为
(3)能判断该反应是否达到化学平衡状态的依据是
a.容器中压强不变b.混合气体中c(CO)不变 c.v正(H2)=v逆(H2O)d.c(CO2)=c(CO)
(4)830℃时,向该容器中起始加入2.0molCO2和1molH2,达平衡时H2的转化率为
考点:化学平衡的计算
专题:化学平衡专题
分析:(1)根据化学平衡常数的概念来书写;
(2)根据温度对化学平衡、化学平衡常数的影响来回答;
(3)化学平衡状态的标志:正逆反应速率相等;
(4)令平衡时参加反应的CO2的物质的量为ymol,根据三段式用y表示出平衡时各组分的物质的量,该反应是气体体积不变的反应,用物质的量代替浓度代入平衡常数表达式列方程计算y的值,据此解答.
(2)根据温度对化学平衡、化学平衡常数的影响来回答;
(3)化学平衡状态的标志:正逆反应速率相等;
(4)令平衡时参加反应的CO2的物质的量为ymol,根据三段式用y表示出平衡时各组分的物质的量,该反应是气体体积不变的反应,用物质的量代替浓度代入平衡常数表达式列方程计算y的值,据此解答.
解答:
解:(1)因平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以K=
,故答案为:
;
(2)化学平衡常数的大小只与温度有关,升高温度,平衡向吸热的方向移动,由表可知:升高温度,化学平衡常数增大,说明化学平衡正向移动,因此正反应方向吸热,故答案为:吸热;
(3)a、反应是一个反应前后体积不变的反应,压强的改变不会要引起平衡移动,故a错误;
b、混合气体中c(CO)不变,则表明反应达到平衡状态,故b正确;
c、化学平衡状态的标志是v正=v逆,所以v正(H2)=v逆(H2O)表明反应达到平衡状态,故c正确;
d、c(CO2)=c(CO),不能判断达到了平衡状态,故d错误;
故选bc;
(4)令平衡时参加反应的CO2的物质的量为ymol,则:
CO2(g)+H2(g)?CO(g)+H2O(g)
开始(mol):2 1 0 0
变化(mol):y y y y
平衡(mol):2-y 1-y y y
故
=1,解得:y=
故平衡后H2的转化率为
=
,
故答案为:
.
| c(CO)c(H 2O) |
| c(CO 2)c(H 2) |
| c(CO)c(H 2O) |
| c(CO 2)c(H 2) |
(2)化学平衡常数的大小只与温度有关,升高温度,平衡向吸热的方向移动,由表可知:升高温度,化学平衡常数增大,说明化学平衡正向移动,因此正反应方向吸热,故答案为:吸热;
(3)a、反应是一个反应前后体积不变的反应,压强的改变不会要引起平衡移动,故a错误;
b、混合气体中c(CO)不变,则表明反应达到平衡状态,故b正确;
c、化学平衡状态的标志是v正=v逆,所以v正(H2)=v逆(H2O)表明反应达到平衡状态,故c正确;
d、c(CO2)=c(CO),不能判断达到了平衡状态,故d错误;
故选bc;
(4)令平衡时参加反应的CO2的物质的量为ymol,则:
CO2(g)+H2(g)?CO(g)+H2O(g)
开始(mol):2 1 0 0
变化(mol):y y y y
平衡(mol):2-y 1-y y y
故
| y×y |
| (2-y)×(1-y) |
| 2 |
| 3 |
故平衡后H2的转化率为
| ||
| 1 |
| 2 |
| 3 |
故答案为:
| 2 |
| 3 |
点评:本题考查化学平衡常数、平衡常数的应用等,难度中等,注意掌握化学平衡常数的用途:1、判断反应进行的程度,2、判断反应的热效应,3、判断反应进行的方向,4、计算转化率等.

练习册系列答案
相关题目
下列试剂可用带玻璃塞的玻璃试剂瓶保存的是( )
| A、氢氟酸 | B、硫酸 |
| C、碳酸钠溶液 | D、氢氧化钠溶液 |
下列各种说法正确的是( )
| A、强碱性溶液中:K+、Al3+、HCO3-、SO42-能大量共存 |
| B、室温下,pH=0的溶液中:Na+、Fe3+、NO3-、SO42-能大量共存 |
| C、0.1mol?L-1 Na2S溶液在中:c(Na+)=c(S2-)+c(HS-)+c(H2S) |
| D、0.1mol/L NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+) |
MOH强碱溶液和等体积、等浓度的HA弱酸混合后,溶液中有关离子浓度的比较正确的是( )
| A、c(M+)>c(OH-)>c(A-)>c(H+) |
| B、c(M+)>c(A-)>c(H+)>c(OH-) |
| C、c(M+)>c(A-)>c(OH-)>c(H+) |
| D、c(M+)>c(H+)>c(A-)>c(OH-) |
下列实验装置图符合实验要求的是( )
A、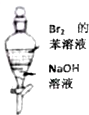 用NaOH溶液除去苯中少量的Br2 |
B、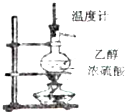 实验室用乙醇和浓硫酸制备乙烯 |
C、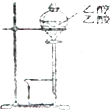 除去乙醇中少量的乙酸 |
D、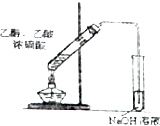 实验室制备并收集乙酸乙酯 |
在水电离出的c(H+)=1×10-12mol/L条件下,下列各组离子一定不能大量共存的是( )
| A、NH4+、NO3-、Cl-、Na+ |
| B、K+、SO32-、Cl-、NO3- |
| C、Na+、SO42-、Cl-、HCO3- |
| D、Na+、NO3-、K+、SO32- |
氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是( )
| A、10mL 1mol/HCN恰好与10mL 1mol/LNaOH溶液完全反应 |
| B、1mol/L HCN溶液的pH约为3 |
| C、在相同条件下,HCN溶液的导电性比强酸溶液的弱 |
| D、HCN易溶于水 |
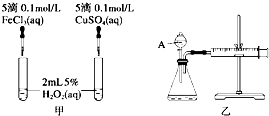 经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验.回答相关问题:
经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验.回答相关问题: 如图装置闭合电键时,电流计A的指针将发生偏转,试回答下列问题.
如图装置闭合电键时,电流计A的指针将发生偏转,试回答下列问题.