题目内容
5.稀有气体元素位于元素周期表第18列,则最外电子排布为4s24p1的元素位于元素周期表( )| A. | 第3列 | B. | 第12列 | C. | 第13列 | D. | 第14列 |
分析 稀有气体元素位于元素周期表第18列,稀有气体的最外层为ns2np6,最外电子排布为4s24p1的元素最外层电子数比稀有气体少5,据此分析.
解答 解:稀有气体元素位于元素周期表第18列,稀有气体的最外层为ns2np6,最外电子排布为4s24p1的元素最外层电子数比稀有气体少5,所以最外电子排布为4s24p1的元素位于元素周期表第13列.
故选C.
点评 本题考查了核外电子排布和元素在周期表中位置的判断,题目难度不大,注意把握稀有气体的最外层电子排布为ns2np6是解题的关键.

练习册系列答案
相关题目
15.下列各组元素中,属于同一周期的是( )
| A. | H、Na | B. | Al、P | C. | O、Cl | D. | Mg、F |
16.除去下列物质中的杂质(括号中为杂质),选用试剂正确的是( )
| A. | Fe2O3(Al2O3)用盐酸 | B. | Cl2(HCl)用NaOH溶液 | ||
| C. | Mg(Al)用纯碱溶液 | D. | SO2(HCl)用饱和的NaHSO3溶液 |
13.下表是四种盐在不同温度下的溶解度(g/100g水):
(假设:盐类共存时不影响各自的溶解度,分离晶体时,溶剂的损耗忽略不计)
用物质的量之比为1:1的硝酸钠和氯化钾为原料,制取硝酸钾晶体,其流程如图所示
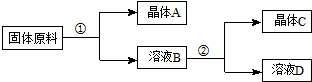
以下说法错误的是( )
(假设:盐类共存时不影响各自的溶解度,分离晶体时,溶剂的损耗忽略不计)
| NaNO3 | KNO3 | NaCl | KCl | |
| 10℃ | 80.5 | 21.2 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |

以下说法错误的是( )
| A. | ①和②的实验过程中,都需要控制温度 | |
| B. | ①实验操作依次为:加水溶解、蒸发浓缩结晶、趁热过滤 | |
| C. | ②实验操作依次为:加水溶解、蒸发浓缩结晶、趁热过滤 | |
| D. | 用95%的酒精洗涤所得的硝酸钾晶体比较好 |
10.实验室保存以下药品,宜用棕色、细口、配有磨口塞玻璃瓶的是( )
| A. | 浓硝酸 | B. | 氢氟酸 | C. | 氢氧化钠溶液 | D. | 硝酸银固体 |
17.NH3与Cl2反应的产物不可能是( )
| A. | N2、HCl | B. | NH4Cl、H2 | C. | N2、NH4Cl | D. | N2、HCl、NH4Cl |
14.关于煤与石油化工的说法,正确的是( )
| A. | 煤焦油干馏可得到苯、甲苯等 | |
| B. | 煤裂化可得到汽油、柴油、煤油等轻质油 | |
| C. | 石油分馏可得到乙烯、丙烯等重要化工产品 | |
| D. | 石油主要是各种烷烃、环烷烃和芳香烃组成的混合物 |
15.现有氢气与氯气的混合气体0.1mol,经充分反应后,通入60mL 2mol/L的NaOH溶液中,所得溶液中只含有2种溶质,其中NaCl为0.1mol.则原混合气体中氢气的物质的量可能是( )
| A. | 0.03mol | B. | 0.04mol | C. | 0.05mol | D. | 0.06mol |
 .
.