题目内容
17.阿伏加德罗常数约为6.02×1023mol-1,下列说法中一定正确的是( )
| A. | 60 g SiO2晶体中含有2×6.02×1023个Si-O键 | |
| B. | 石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如图甲),则0.12 g石墨烯中含有6.02×1022个碳原子 | |
| C. | 720 g C60晶体(如图乙)中含有6.02×1023个晶胞结构单元 | |
| D. | 14 g两种烯烃CnH2n和CmH2m混合物,含有共用电子对数目为3×6.02×1023 |
分析 A.每个硅原子含有4个Si-O键,根据二氧化硅的物质的量计算含有的Si-O键;
B.根据N=$\frac{m}{M}$×NA计算0.12 g石墨烯中含有的碳原子数目;
C.根据C60晶体为面心立方排布,所以每个C60晶胞有4个C60分子 (面心3个,顶点1个)分析;
D.根据烯烃的最简式计算出含有碳原子和氢原子的物质的量,再根据碳原子和氢原子写成的共价键计算出总共含有的共用电子对数目..
解答 解:A.60gSiO2晶体的物质的量是1mol,每个硅原子含有4个Si-O键,所以1molSiO2含4molSi-O键,故A错误;
B.0.12g石墨含$\frac{0.12g}{12g/mol}$×6.02×1023/mol=6.02×1021个碳原子,故B错误;
C.720g C60晶体含有1molC60,根据图示可知,C60晶体为面心立方排布,所以每个C60晶胞有4个C60分子(面心3个,顶点1个),1molC60分子可以形成0.25mol晶胞结构单元,即含有1.505×1023个晶胞结构单元,故C错误;
D.烯烃中,1molC可以形成1mol碳碳共用电子对、1molH可以形成1molC-H共用电子对;烯烃的最简式为:CH2,14g混合物中含有1molCH2,能够形成1molC-C共用电子对和2molC-H共用电子对,总共形成3mol共用电子对,含有共用电子对数目为3×6.02×1023,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数,该题是高考中的常见题型,属于中等难度的试题,试题基础性强,在注重对学生基础知识训练和检验的同时,侧重对学生实验答题能力的培养和方法与技巧的指导和训练.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.下列是四种物质的分离实验,已知X与NaOH溶液不反应,则关于X、Y、Z、W所代表的四种物质说法正确的是( )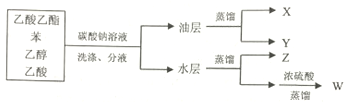

| A. | X是最简单的芳香烃,分子中含有三个碳碳双键 | |
| B. | Y是具有芳香气味的液体,难溶于水,易溶于有机溶剂,能发生水解反应 | |
| C. | Z是无色,有特殊香味的液体,与硫酸混合在140℃可以制备乙烯 | |
| D. | W是有强烈刺激性气味的无色液体,可与氢气发生加成反应,生成Z |
6.下列物质:①BeCl2 ②C2H4 ③P4 ④BF3 ⑤NF3 ⑥H2O2,其中含极性键的非极性分子是( )
| A. | ①③④ | B. | ②③⑥ | C. | ①②④ | D. | ③④⑤ |
7.下列反应中,属于吸热反应的是( )
| A. | Na与H2O的反应 | B. | Al与Fe2O3的反应 | ||
| C. | 石灰石高温分解 | D. | NaOH与HCl的反应 |
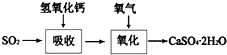


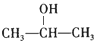 +NaCl;
+NaCl;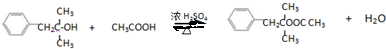 ;
;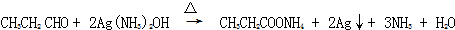 .
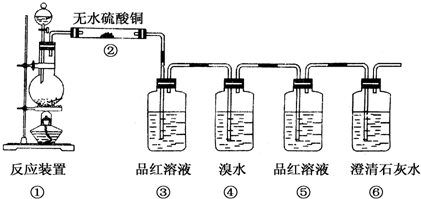
.
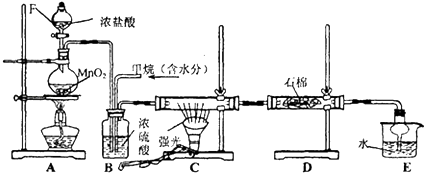
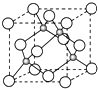 A、B、C是短周期非金属元素,核电荷数依次增大.A元素原子核外有三种不同的能级且各个能级所填充的电子数相同,C是地壳中含量最多的元素.D、E是第四周期元素,其中E元素的核电荷数为29.D原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空:
A、B、C是短周期非金属元素,核电荷数依次增大.A元素原子核外有三种不同的能级且各个能级所填充的电子数相同,C是地壳中含量最多的元素.D、E是第四周期元素,其中E元素的核电荷数为29.D原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空: