题目内容
3.下列各组物质中,化学键类型都相同的是( )| A. | HCl与NaCl | B. | H2O与MgO | C. | H2O和CO2 | D. | H2SO4和NaNO3 |
分析 一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,以此来解答.
解答 解:A.HCl含共价键,NaCl含离子键,故A不选;
B.H2O含共价键,MgO含离子键,故B不选;
C.均只含共价键,故C选;
D.H2SO4只含共价键,NaNO3含离子键和共价键,故D不选;
故选C.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列说法中错误的是( )
| A. | 食盐可作为调味剂、食品防腐剂,还可用于调节体液电解质平衡 | |
| B. | 碘是人体必需的影响智力发育的微量元素,但也不能摄入过多 | |
| C. | 油脂是高能量营养物质,肥胖者不能食用 | |
| D. | 面粉中添加适量的小苏打后做成馒头,既无酸味又疏松可口 |
11.一定条件下,可逆反应N2+3H2═2NH3(放热反应) 达到平衡后,只改变一个条件,下列叙述错误的是( )
| A. | 加催化剂,v正、v逆 都发生变化,且变化的倍数相等 | |
| B. | 加压,v正、v逆 都增大,且v正 增大的倍数大于V逆增大的倍数 | |
| C. | 增大氮气的浓度,H2的平衡转化率增大 | |
| D. | 降温,v正、v逆 都减小,且v正 减小的倍数大于v逆减小的倍数 |
8.目前,消除氮氧化物污染有多种方法.
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4 (g)+4NO2 (g)═4NO(g)+CO2 (g)+2H2 O(g)△H=-574kJ•mol-1
②CH4 (g)+4NO(g)═2N2 (g)+CO2 (g)+2H2 O(g)△H=-1160kJ•mol-1
③H2O(g)═H2O(l)△H=-44.0kJ•mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(1)△H=-955kJ•mol-1.
(2)酸性KMnO4溶液能与草酸(H2C2O4)溶液反应.某探究小组利用反应过程中溶液紫色消失快慢的方法来研究影响反应速率的因素.
Ⅰ.实验前首先用浓度为0.1000mol•L-1酸性KMnO4标准溶液滴定未知浓度的草酸.
①写出滴定过程中发生反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
②滴定过程中操作滴定管的图示正确的是A.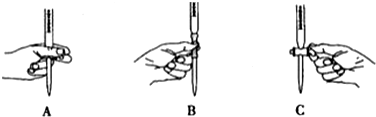
③若配制酸性KMnO4标准溶液时,俯视容量瓶的刻度线,会使测得的草酸溶液浓度偏低(填“偏高”、“偏低”、或“不变”).
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol•L-1.用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为8mL).
④写出表中a 对应的实验目的探究不同温度对反应速率的影响;
⑤该小组同学对实验1和3分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
分析上述数据后得出“当其它条件相同时,酸性高锰酸钾溶液的浓度越小,褪色时间就越短,即反应速率就越快”的结论.某同学认为该小组“探究反应物浓度对速率影响”的实验方案设计中存在问题,从而得到了错误的实验结论,请简述改进的实验方案其它条件相同时,利用等量且少量的高锰酸钾与等体积不同浓度的足量草酸溶液反应,测量溶液褪色时间.
⑥该实验中使用的催化剂应选择MnSO4并非MnCl2,原因为(离子方程式表示)为2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O.
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4 (g)+4NO2 (g)═4NO(g)+CO2 (g)+2H2 O(g)△H=-574kJ•mol-1
②CH4 (g)+4NO(g)═2N2 (g)+CO2 (g)+2H2 O(g)△H=-1160kJ•mol-1
③H2O(g)═H2O(l)△H=-44.0kJ•mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(1)△H=-955kJ•mol-1.
(2)酸性KMnO4溶液能与草酸(H2C2O4)溶液反应.某探究小组利用反应过程中溶液紫色消失快慢的方法来研究影响反应速率的因素.
Ⅰ.实验前首先用浓度为0.1000mol•L-1酸性KMnO4标准溶液滴定未知浓度的草酸.
①写出滴定过程中发生反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
②滴定过程中操作滴定管的图示正确的是A.

③若配制酸性KMnO4标准溶液时,俯视容量瓶的刻度线,会使测得的草酸溶液浓度偏低(填“偏高”、“偏低”、或“不变”).
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol•L-1.用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为8mL).
| 实验编号 | 温 度(℃) | 催化剂用量(g) | 酸性高锰酸钾溶液 | 实验目的 a.实验1和2探究 探究不同温度对反应速率的影响 b.实验1 和3 探究反应物浓度对该反应速率的影响; c.实验1 和4 探究催化剂对该反应速率的影 响. | |
| 体积(mL) | 浓度 (mol•L-1) | ||||
| 1 | 25 | 0.5 | 4 | 0.1000 | |
| 2 | 50 | 0.5 | 4 | 0.1000 | |
| 3 | 25 | 0.5 | 4 | 0.0100 | |
| 4 | 25 | 0 | 4 | 0.1000 | |
⑤该小组同学对实验1和3分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
| 实验编号 | 溶液褪色所需时间(min) | ||
| 第1 次 | 第2 次 | 第3 次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
⑥该实验中使用的催化剂应选择MnSO4并非MnCl2,原因为(离子方程式表示)为2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O.
15.下列叙述正确的是( )
①淀粉和纤维素互为同分异构体
②麦芽糖与蔗糖的水解产物均只含葡萄糖
③乙烯和苯都能使溴水褪色,褪色的原理相同
④乙醇、乙酸、乙酸乙酯都能发生取代反应
⑤酶、木材、蚕丝、动物的皮毛主要成分都是蛋白质
⑥除去乙烷中混有的乙烯可用酸性高锰酸钾溶液
⑦淀粉、油脂、蛋白质在一定条件下都能发生水解反应.
①淀粉和纤维素互为同分异构体
②麦芽糖与蔗糖的水解产物均只含葡萄糖
③乙烯和苯都能使溴水褪色,褪色的原理相同
④乙醇、乙酸、乙酸乙酯都能发生取代反应
⑤酶、木材、蚕丝、动物的皮毛主要成分都是蛋白质
⑥除去乙烷中混有的乙烯可用酸性高锰酸钾溶液
⑦淀粉、油脂、蛋白质在一定条件下都能发生水解反应.
| A. | ①②④⑦ | B. | ②④⑤⑦ | C. | ③④⑥⑦ | D. | ④⑦ |
12.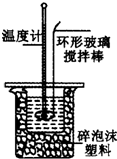 某小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
某小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
I.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mLNaOH溶液,至少需要称量NaOH固体5.0g.
(2)从如表中选择称量NaOH固体所需要的仪器是(填字母):
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
(3)取50mL.NaOH溶液和30mL硫酸溶液进行实验,实验数据如表.
①上表中的温度差平均值为4.0℃;
②近似认为0.50mol/L NaOH溶液和O.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃),则中和热△H-53.5kJ/mol (取小数点后一位).
③上述实验数值结果与57.3kJ•mol叫有偏差,产生偏差的原因可能是acd(填字母).
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
 某小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
某小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.I.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mLNaOH溶液,至少需要称量NaOH固体5.0g.
(2)从如表中选择称量NaOH固体所需要的仪器是(填字母):
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
(3)取50mL.NaOH溶液和30mL硫酸溶液进行实验,实验数据如表.
| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.6 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50mol/L NaOH溶液和O.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃),则中和热△H-53.5kJ/mol (取小数点后一位).
③上述实验数值结果与57.3kJ•mol叫有偏差,产生偏差的原因可能是acd(填字母).
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
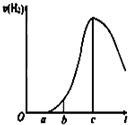 某化学小组进行了关于“活泼金属与酸反应”的实验,得出了一些有趣的想法,请你帮助他们,完成一些判断.将5.4g铝片投入500mL 0.5mol•L-1的硫酸溶液中,如图为反应产氢速率与反应时间的关系图.
某化学小组进行了关于“活泼金属与酸反应”的实验,得出了一些有趣的想法,请你帮助他们,完成一些判断.将5.4g铝片投入500mL 0.5mol•L-1的硫酸溶液中,如图为反应产氢速率与反应时间的关系图.