题目内容
17.已知:Ca(ClO)2+4HCl(浓)=CaCl2+2H2O+2Cl2↑,若反应后产生氯气2.24L(标准状况),则消耗Ca(ClO)2的物质的量为0.05mol,被氧化的Cl-为0.1mol,反应时电子转移的总数为6.02×1022个.分析 根据n=$\frac{V}{{V}_{m}}$计算氯气物质的量,根据方程式计算耗Ca(ClO)2的物质的量和消耗HCl的物质的量,以及电子转移总数,由此分析解答.
解答 解:标况下,2.24L氯气的物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,
由Ca(Cl)2+4HCl(浓)═CaCl+2H2O+2Cl2↑,可知耗Ca(ClO)2的物质的量为$\frac{0.1}{2}$=0.05mol,被氧化的Cl-为0.1mol×$\frac{1}{2}$=0.1mol,反应时电子转移的总数为0.1×6.02×1023=6.02×1022个,故答案为:0.05mol;0.1;6.02×1022.
点评 本题考查物质的量有关计算、化学方程式计算,比较基础,侧重对基础知识的巩固.

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目
2.亚硝酸在化学反应中既可作氧化剂又可作还原剂,在亚硝酸(HNO2)作氧化剂时,可能生成的产物是( )
①NH3 ②N2 ③N2O3 ④N2O5 ⑤NO2.
①NH3 ②N2 ③N2O3 ④N2O5 ⑤NO2.
| A. | ①和② | B. | ③和④ | C. | ④和⑤ | D. | 只有③ |
7.在体积固定,容积为2L的密闭容器中进行如下化学反应:
CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)能判断该反应一定达到化学平衡状态的依据是BC.
A.容器中压强不再改变 B.混合气体中c(CO)不再改变
C.v(H2)正=v(H2O)逆 D.c(CO2)=c(CO)
(4)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为
2mol/L,c(H2)为1.5mol/L,c(CO)为1mol/L,c(H2O)为3mol/L,则下一时刻,反应向逆向(填“正向”或“逆向”)进行.
(5)保持容器体积不变,下列措施中一定能使H2的转化率增大的有CD.
A.充入氦气
B.使用催化剂
C.平衡后再向容器内通入一定量CO2
D.升高温度
(6)在830℃时,发生上述反应,若开始时加入0.3mol CO2和0.2mol H2,经过3分钟刚好达到平衡,以CO的浓度变化表示的化学反应速率为v(CO)=0.02mol•L-1•min-1.
CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)能判断该反应一定达到化学平衡状态的依据是BC.
A.容器中压强不再改变 B.混合气体中c(CO)不再改变
C.v(H2)正=v(H2O)逆 D.c(CO2)=c(CO)
(4)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为
2mol/L,c(H2)为1.5mol/L,c(CO)为1mol/L,c(H2O)为3mol/L,则下一时刻,反应向逆向(填“正向”或“逆向”)进行.
(5)保持容器体积不变,下列措施中一定能使H2的转化率增大的有CD.
A.充入氦气
B.使用催化剂
C.平衡后再向容器内通入一定量CO2
D.升高温度
(6)在830℃时,发生上述反应,若开始时加入0.3mol CO2和0.2mol H2,经过3分钟刚好达到平衡,以CO的浓度变化表示的化学反应速率为v(CO)=0.02mol•L-1•min-1.
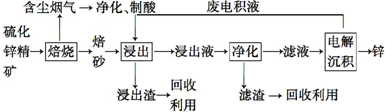
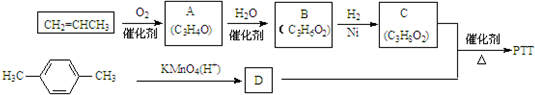
 .①分子式为C4H6O ②含有1个-CH3
.①分子式为C4H6O ②含有1个-CH3 ,反应类型为缩聚反应.
,反应类型为缩聚反应.