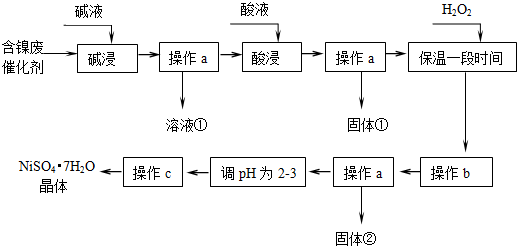
题目内容
(1)若把H2O2看成是二元弱酸,请写出在水中的电离方程式:
(2)碘也可用作心脏起搏器电源--锂碘电池的材料.
该电池反应为2Li(s)+I2(s)═2LiI(s)△H
已知:4Li(s)+O2(g)═2Li2O(s)△H1
4LiI(s)+O2(g)═2I2(s)+2Li2O(s)△H2
则电池反应的△H=
(3)某温度时,在2L容器中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.由此分析,该反应的化
学方程式为 ;从反应开始至2min时,Z的反应速率为 .
(4)在某温度时,测得0.01mol?L-1的NaOH溶液的pH=10.在此温度下,将1mL 0.1mol/L KOH溶液加水稀释至1L,则溶液的pH为若加水稀释至1000L,则溶液的pH为.

(2)碘也可用作心脏起搏器电源--锂碘电池的材料.
该电池反应为2Li(s)+I2(s)═2LiI(s)△H
已知:4Li(s)+O2(g)═2Li2O(s)△H1
4LiI(s)+O2(g)═2I2(s)+2Li2O(s)△H2
则电池反应的△H=
(3)某温度时,在2L容器中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.由此分析,该反应的化
学方程式为
(4)在某温度时,测得0.01mol?L-1的NaOH溶液的pH=10.在此温度下,将1mL 0.1mol/L KOH溶液加水稀释至1L,则溶液的pH为若加水稀释至1000L,则溶液的pH为.

考点:电离方程式的书写,热化学方程式,反应速率的定量表示方法
专题:
分析:(1)双氧水可以可作是二元弱酸,说明双氧水分子能发生两步电离;
(2)依据盖斯定律计算反应热;
(3)根据曲线的变化趋势判断反应物和生成物,根据物质的量变化之比等于化学计量数之比书写方程式;
根据v=
计算反应速率;
(4)依据0.01mol?L-1的NaOH溶液的pH=10,计算此温度下Kw,然后依据Kw=[H+][OH-]结合溶液稀释规律解答.
(2)依据盖斯定律计算反应热;
(3)根据曲线的变化趋势判断反应物和生成物,根据物质的量变化之比等于化学计量数之比书写方程式;
根据v=
| △C |
| △t |
(4)依据0.01mol?L-1的NaOH溶液的pH=10,计算此温度下Kw,然后依据Kw=[H+][OH-]结合溶液稀释规律解答.
解答:
解:(1)双氧水可以可作是二元弱酸,说明双氧水分子能发生两步电离,其电离方程式为H2O2? H++HO2-、HO2-?
H++HO2-、HO2-? H++O22-;
H++O22-;
故答案为:H2O2? H++HO2-、HO2-?
H++HO2-、HO2-? H++O22-;
H++O22-;
(2)①4Li(s)+O2(g)═2Li2O(s)△H1
②4LiI(s)+O2(g)═2I2(s)+2Li2O(s)△H2
依据盖斯定律
得:2Li(s)+I2(s)═2LiI(s),所以△H=
(△H1-△H2);
故答案为:
(△H1-△H2);
(3)从曲线的变化趋势可以看出,从反应开始到达到平衡,X、Y的物质的量减少,应为反应物,Z的物质的量增加,应为生成物,从反应开始到第2分钟反应到达平衡状态,X、Y消耗的物质的量分别为0.3 mol、0.1 mol,Z的生成的物质的量为0.2 mol,因此三者比例为3:1:2,
物质的量变化之比等于化学计量数之比,则化学方程式为3X+Y 2Z,
2Z,
v=
=
=0.025 mol?L-1?min-1;
故答案为:3X+Y 2Z;0.025 mol?L-1?min-1;
2Z;0.025 mol?L-1?min-1;
(4)在某温度时,测得0.01mol?L-1的NaOH溶液的pH=10,则C(H+)=10-10mol/L,该温度下Kw=10-10×10-2=10-12,
溶液稀释前后溶质的物质的量不变则:1mL×0.1mol/L=1000ml×C(OH-),解得C(OH-)=10-4mol/L,则此时氢离子的物质的量浓度为=
=10-8(mol/L),PH=-lg[H+]=8;
氢氧化钠溶液当稀释1000L时,溶液PH值接近水的pH,该温度下有水电离出氢离子的物质的量浓度C(H+)=10-6mol/L,溶液的pH值=-lg[H+]=6;
故答案为:8;6.
 H++HO2-、HO2-?
H++HO2-、HO2-? H++O22-;
H++O22-;故答案为:H2O2?
 H++HO2-、HO2-?
H++HO2-、HO2-? H++O22-;
H++O22-;(2)①4Li(s)+O2(g)═2Li2O(s)△H1
②4LiI(s)+O2(g)═2I2(s)+2Li2O(s)△H2
依据盖斯定律
| (①-②) |
| 2 |
| 1 |
| 2 |
故答案为:
| 1 |
| 2 |
(3)从曲线的变化趋势可以看出,从反应开始到达到平衡,X、Y的物质的量减少,应为反应物,Z的物质的量增加,应为生成物,从反应开始到第2分钟反应到达平衡状态,X、Y消耗的物质的量分别为0.3 mol、0.1 mol,Z的生成的物质的量为0.2 mol,因此三者比例为3:1:2,
物质的量变化之比等于化学计量数之比,则化学方程式为3X+Y
 2Z,
2Z,v=
| △C |
| △t |
| ||
| 2min |
故答案为:3X+Y
 2Z;0.025 mol?L-1?min-1;
2Z;0.025 mol?L-1?min-1;(4)在某温度时,测得0.01mol?L-1的NaOH溶液的pH=10,则C(H+)=10-10mol/L,该温度下Kw=10-10×10-2=10-12,
溶液稀释前后溶质的物质的量不变则:1mL×0.1mol/L=1000ml×C(OH-),解得C(OH-)=10-4mol/L,则此时氢离子的物质的量浓度为=
| 10-12 |
| 10-4 |
氢氧化钠溶液当稀释1000L时,溶液PH值接近水的pH,该温度下有水电离出氢离子的物质的量浓度C(H+)=10-6mol/L,溶液的pH值=-lg[H+]=6;
故答案为:8;6.
点评:本题考查了电离方程式的书写、反应热的计算、溶液pH的计算,明确电解质的强弱、盖斯定律的应用,溶液稀释的规律是解题关键,题目难度中等.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
决定一定物质的量的气体体积大小的主要因素有( )
| A、气体分子的直径 |
| B、气体分子的数目 |
| C、气体分子间距离 |
| D、气体分子的相对分子质量 |
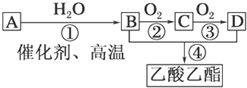 根据所给信息填空
根据所给信息填空