题目内容
下列有关说法正确的是( )
| A、常温下Ksp(Ag2CrO4)=1.1×10-12,Ksp(AgCl)=1.8×10-10,则Ag2CrO4的溶解度小于AgCl |
| B、纯碱溶于热水中,去油污效果增强,说明纯碱的水解是放热反应 |
| C、为保护海轮的船壳,常在船壳上镶入锌块 |
| D、以熔融Al2O3为电解质进行电解冶炼铝,熔融体中Al3+向阳极移动 |
考点:难溶电解质的溶解平衡及沉淀转化的本质,金属的电化学腐蚀与防护,盐类水解的应用,电解原理
专题:
分析:A、依据溶度积常数的概念和有关计算判断即可;
B、升温碳酸钠碱性增强,说明水解是吸热反应;
C、根据钢铁的电化学防护原理分析;
D、电解时阳离子在阴极得电子.
B、升温碳酸钠碱性增强,说明水解是吸热反应;
C、根据钢铁的电化学防护原理分析;
D、电解时阳离子在阴极得电子.
解答:
解:A、假设Ag2CrO4饱和溶液中Ag+的浓度为x,则CrO42-的浓度为0.5x,由溶度积常数的表达式可知
Ksp(Ag2CrO4)=x2×0.5x=0.5x3=2.0×10-12,x3=4.0×10-12,即x═
≈10-4,因为AgCl饱和溶液中Ag+的浓度为
≈10-5,所以溶解度Ag2CrO4>AgCl,故A错误;
B、纯碱溶于热水中,去油污效果增强,说明升温碳酸钠溶液碱性增强,所以升温促进水解,即水解是吸热反应,故B错误;
C、钢铁与活泼性强的金属构成原电池时,活泼性强的金属被腐蚀,钢铁被保护,所以为保护海轮的船壳,常在船壳上镶入锌块,故C正确;
D、电解时阳离子在阴极得电子,所以以熔融Al2O3为电解质进行电解冶炼铝,熔融体中Al3+向阴极移动,故D错误;故选C.
Ksp(Ag2CrO4)=x2×0.5x=0.5x3=2.0×10-12,x3=4.0×10-12,即x═
| 3 | 1.1×10-12 |
| 1.8×10-10 |
B、纯碱溶于热水中,去油污效果增强,说明升温碳酸钠溶液碱性增强,所以升温促进水解,即水解是吸热反应,故B错误;
C、钢铁与活泼性强的金属构成原电池时,活泼性强的金属被腐蚀,钢铁被保护,所以为保护海轮的船壳,常在船壳上镶入锌块,故C正确;
D、电解时阳离子在阴极得电子,所以以熔融Al2O3为电解质进行电解冶炼铝,熔融体中Al3+向阴极移动,故D错误;故选C.
点评:本题考查了反应自发性的判断,影响水解的因素,钢铁的电化学防护,电解原理的应用,属于基础知识的考查,难度不大.

练习册系列答案
相关题目
下列离子方程式或化学方程式与所述事实相符且正确的是( )
A、硫酸与氢氧化钡反应的中和热化学反应方程式为:
| ||||||
| B、向0.1 mol?L-1、pH=1的NaHA溶液中加入NaOH溶液:H++OH-=H2O | ||||||
| C、以金属银为阳极电解饱和硫酸铜溶液:2Cu2++2H2O=2Cu+O2↑+4H+ | ||||||
| D、NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
现有常温下的四种溶液(如下表):
下列有关叙述中正确的是( )
| ① | ② | ③ | ④ | |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
| A、分别加水稀释10倍,四种溶液的pH:②>①>④>③ |
| B、将③、④分别稀释到pH=5,由水电离出氢离子的浓度均减小100倍 |
| C、在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变 |
| D、将①、④两种溶液等体积混合,所得溶液中:c(OH-):c(H+)>1 |
科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为甲烷,然后将甲烷通入以KOH为电解质的燃料电池发电.电池负极反应为( )
| A、CH4-8e-+8OH-=CO2+6H2O |
| B、O2+4H++4e-=2H2O |
| C、CH4+10OH--8e-=C32-+7H2O |
| D、O2+2H2O+4e-=4OH- |
下列元素性质的递变规律正确的是( )
| A、第一电离能:B<Be<Mg<Na |
| B、元素的电负性:O>N>S>P |
| C、气态氢化物的稳定性:NH3<CH4<PH3<SiH4 |
| D、原子半径:Be<B<C<N |
以下关于实验操作的说法正确的是( )
| A、过滤时为加快速度可以用玻璃棒轻微搅拌 |
| B、蒸发时蒸发皿放在石棉网上 |
| C、可用酒精萃取碘水中的碘 |
| D、蒸馏时温度计液泡应与蒸馏烧瓶支管口平齐 |

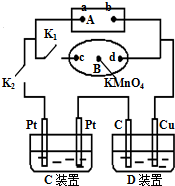 (1)如图所示,A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料见图,电解质溶液见已知.
(1)如图所示,A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料见图,电解质溶液见已知.