题目内容
(14分)PCl3可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
熔点/℃ | 沸点/℃ | 密度/g·mL-1 | 其他 | |
黄磷 | 44.1 | 280.5 | 1.82 | 2P(过量)+3Cl2 |
PCl3 | —112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
POCl3 | 2 | 105.3 | 1.675 | 遇水生成H3PO4和HCl,能溶于PCl3 |
(一)制备:下图是实验室制备PCl3的装置(部分仪器已省略)
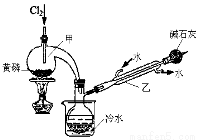
(1)仪器乙的名称 。
(2)实验室以制备Cl2的离子方程式: 。
(3)碱石灰的作用是 , 。
(4)向仪器甲中通入干燥Cl2之前,应先通入一段时间的CO2,其目的是 。
(二)提纯:
(5)粗产品品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后,通过 (填实验操作名称),即可得到PCl3的纯品。
(三)分析:
测定产品中PCl3纯度的方法如下:迅速称取m g产品,水解完全后配成500mL溶液,取出25.00mL加入过量的c1 mol/L V1 mL 碘溶液,充分反应后再用c2 mol/L Na2S2O3溶液滴定过量的碘,终点时消耗V2 mL Na2S2O3溶液。
已知:H3PO3+H2O+I2=H3PO4+2HI;I2+2Na2S2O3=2NaI+Na2S4O6;假设测定过程中没有其他反应。
(6)根据上述数据,该产品中PCl3的质量分数为 (用含字母的代数式表示、不必化简)。
(1)冷凝管 ;(2)MnO2+4H++2Cl—  Mn2++2H2O+Cl2↑;
Mn2++2H2O+Cl2↑;
(3)吸收多余的Cl2,防止污染环境; 防止空气中的水分进入,影响产品。
(4)排尽装置中的空气,防止O2和水与PCl3反应
(5)蒸馏
⑹
【解析】
试题分析:(1)仪器乙的名称是冷凝管;(2)在实验室中一般是用浓盐酸与MnO2共热来制取氯气的,反应的离子方程式是MnO2+4H++2Cl—  Mn2++2H2O+Cl2↑;(3)由于发生反应的氯气是有毒气体,不能随意排入大气,用碱石灰吸收,同时PCl3容易吸收水分而潮解,所以用碱石灰还可以吸收空气中的水蒸气。故碱石灰的作用是吸收多余的Cl2,防止污染环境; 防止空气中的水分进入,影响产品。(4)PCl3容易与水、氧气发生反应,在制取PCl3前先通入一段时间的CO2,再通入干燥Cl2就是为了排尽装置中的空气,防止O2和水与PCl3反应;(5)粗产品品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后,由于PCl3、POCl3是沸点不同的互溶的液体混合物,所以可以通过蒸馏的方法分离得到;(6) H3PO3反应消耗的I2的物质的量是(c1 ? V1—1/2 c2 ? V2)×10-3×(500÷25.00)mol=(c1 ? V1—1/2 c2 ? V2)×10-3×20mol,根据方程式可知含有H3PO3的物质的量是(c1 ? V1—1/2 c2 ? V2)×10-3×20mol,所以该产品中PCl3的质量分数为{[(c1 ? V1—1/2 c2 ? V2)×10-3×20mol×137.5g/mol] ÷m}×100%=
Mn2++2H2O+Cl2↑;(3)由于发生反应的氯气是有毒气体,不能随意排入大气,用碱石灰吸收,同时PCl3容易吸收水分而潮解,所以用碱石灰还可以吸收空气中的水蒸气。故碱石灰的作用是吸收多余的Cl2,防止污染环境; 防止空气中的水分进入,影响产品。(4)PCl3容易与水、氧气发生反应,在制取PCl3前先通入一段时间的CO2,再通入干燥Cl2就是为了排尽装置中的空气,防止O2和水与PCl3反应;(5)粗产品品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后,由于PCl3、POCl3是沸点不同的互溶的液体混合物,所以可以通过蒸馏的方法分离得到;(6) H3PO3反应消耗的I2的物质的量是(c1 ? V1—1/2 c2 ? V2)×10-3×(500÷25.00)mol=(c1 ? V1—1/2 c2 ? V2)×10-3×20mol,根据方程式可知含有H3PO3的物质的量是(c1 ? V1—1/2 c2 ? V2)×10-3×20mol,所以该产品中PCl3的质量分数为{[(c1 ? V1—1/2 c2 ? V2)×10-3×20mol×137.5g/mol] ÷m}×100%= .
.
考点:考查仪器的识别、离子方程式的书写、物质的选择使用、化学实验操作即物质含量的计算的知识。

 2PCl3;2P+5Cl2(过量)
2PCl3;2P+5Cl2(过量)  n C(g)( ΔH<0),生成物C的浓度随压强变化并建立平衡的关系图,
n C(g)( ΔH<0),生成物C的浓度随压强变化并建立平衡的关系图,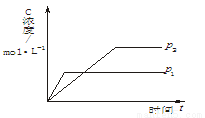
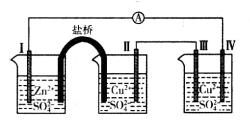
 →电极I
→电极I

