题目内容
如图是某硫酸试剂瓶的标签上的部分信息。下列说法正确的是

A.常温下,该试剂可与金属铝反应生成大量的无色气体
B.1 mol Zn与足量的该硫酸反应生成2 g氢气
C.该硫酸与等体积水混合所得溶液的物质的量浓度大于9.2 mol/L
D.向50 mL该硫酸中加入足量的铜片,加热,反应后被还原的硫酸的物质的量小于0.46 mol
CD
【解析】
试题分析:A.该硫酸是浓硫酸。常温下,浓硫酸遇金属铝会发生钝化,不能继续反应,因此不会生成大量的无色气体,错误;B.1 mol Zn与足量的该硫酸发生反应产生SO2,不能产生氢气,错误;C.由于硫酸浓度越大,密度就越大,所以该硫酸与等体积水混合所得溶液的物质的量浓度大于9.2 mol/L,正确;D.该硫酸的物质的量浓度是18.4mol/L,50 mL该硫酸中溶质的物质的量浓度是0.92mol,若硫酸完全反应,被还原的硫酸是0.46mol,但是只有浓硫酸能够与Cu发生反应,随着反应的进行,硫酸变为稀硫酸,反应就不再发生,因此向50 mL该硫酸中加入足量的铜片,加热,反应后被还原的硫酸的物质的量小于0.46 mol,正确。
考点:考查浓硫酸的性质、稀释、及发生反应的原理及相应计算的知识。

(14分)PCl3可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
熔点/℃ | 沸点/℃ | 密度/g·mL-1 | 其他 | |
黄磷 | 44.1 | 280.5 | 1.82 | 2P(过量)+3Cl2 |
PCl3 | —112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
POCl3 | 2 | 105.3 | 1.675 | 遇水生成H3PO4和HCl,能溶于PCl3 |
(一)制备:下图是实验室制备PCl3的装置(部分仪器已省略)
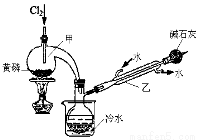
(1)仪器乙的名称 。
(2)实验室以制备Cl2的离子方程式: 。
(3)碱石灰的作用是 , 。
(4)向仪器甲中通入干燥Cl2之前,应先通入一段时间的CO2,其目的是 。
(二)提纯:
(5)粗产品品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后,通过 (填实验操作名称),即可得到PCl3的纯品。
(三)分析:
测定产品中PCl3纯度的方法如下:迅速称取m g产品,水解完全后配成500mL溶液,取出25.00mL加入过量的c1 mol/L V1 mL 碘溶液,充分反应后再用c2 mol/L Na2S2O3溶液滴定过量的碘,终点时消耗V2 mL Na2S2O3溶液。
已知:H3PO3+H2O+I2=H3PO4+2HI;I2+2Na2S2O3=2NaI+Na2S4O6;假设测定过程中没有其他反应。
(6)根据上述数据,该产品中PCl3的质量分数为 (用含字母的代数式表示、不必化简)。


 2PCl3;2P+5Cl2(过量)
2PCl3;2P+5Cl2(过量) 