题目内容
同温同压下,等体积的两容器内分别充满由14N、13C、18O三种原子构成的一氧化氮和一氧化碳,下列说法正确的是
A.所含分子数和质量均不相同
B.含有相同的分子数和电子数
C.含有相同的质子数和中子数
D.含有相同数目的中子、原子和分子
D
【解析】
试题分析:同温同压下,等体积的两容器内气体的分子数相同,所以14N18O、13C18O分子数相同。A、14N18O、13C18O分子数相同,二者摩尔质量不同,所以分子数相同,质量不同,错误;B、14N18O、13C18O分子数相同,14N18O、13C18O分子含有电子数分别为15、14,所以含有的电子数不同,错误;C、14N18O、13C18O分子数相同,14N18O、13C18O分子含有质子数数分别为15、14,分子数中中子数都是17,所以含有的质子数不同,中子数相同,错误;D、14N18O、13C18O分子数相同,14N18O、13C18O分子都是双原子分子,分子数中中子数都是17,所以原子数目与中子数也相等,正确。
考点:考查阿伏加德罗定律,原子结构。

(16+2分)目前低碳经济已成为科学家研究的主要课题之一,如何降低大气中CO2的含量及有效地开发利用CO2,引起全世界的关注:
(1)用电弧法合成的储氢材料常伴有大量的碳纳米颗粒(杂质),这些杂质颗粒通常用硫酸酸化的锰酸钾氧化除去,在反应中,杂质碳被氧化为无污染气体而除去,Mn元素转变为Mn2+,请写出对应的化学方程式并配平: ;
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下两组数据:
CO2(g)+H2(g),得到如下两组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
①实验2条件下的H2O 体积分数为 ;
②下列方法中可以证明上述已达平衡状态的是 ;
a.单位时间内生成n mol H2的同时生成n mol CO
b.容器内压强不再变化
c.混合气体密度不再变化
d.混合气体的平均相对分子质量不再变化
e.CO2的质量分数不再变化
③已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:
气化反应式 | lgK | ||
700K | 900K | 1200K | |
C(s)+H2O(g)=CO(g)+H2(g) | -2.64 | -0.39 | 1.58 |
C(s)+2H2O(g)=CO2(g)+2H2(g) | -1.67 | -0.03 | 1.44 |
则反应CO(g)+H2O(g) CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)= _。
CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)= _。
(3)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g) △ H 1=-393.5kJ·mol-1
CO2(g)+C(s) =2CO(g) △ H 2=+172.5kJ·mol-1
S(s)+O2(g) =SO2(g) △ H 3=-296.0kJ·mol-1
请写出CO除SO2的热化学方程式 。
(4)25℃时,在20 mL0.1 mol/L醋酸中加入V mL0.1 mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,

下列说法正确的是________。
A.pH=3的CH3COOH溶液和pH=11的CH3COONa溶液中,由水电离出的c(OH—)相等
B.①点时pH=6,此时溶液中,c(CH3COO—)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(CH3COO—)=c(Na+)
D.③点时V=20mL,此时溶液中c(CH3COO—)< c(Na+)=0.1mol/L
(5)下图是一种新型燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。回答下列问题:

①写出A极发生的电极反应式 ;
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与 极(填“C”或“D”)相连。
(14分)PCl3可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
熔点/℃ | 沸点/℃ | 密度/g·mL-1 | 其他 | |
黄磷 | 44.1 | 280.5 | 1.82 | 2P(过量)+3Cl2 |
PCl3 | —112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
POCl3 | 2 | 105.3 | 1.675 | 遇水生成H3PO4和HCl,能溶于PCl3 |
(一)制备:下图是实验室制备PCl3的装置(部分仪器已省略)
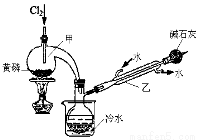
(1)仪器乙的名称 。
(2)实验室以制备Cl2的离子方程式: 。
(3)碱石灰的作用是 , 。
(4)向仪器甲中通入干燥Cl2之前,应先通入一段时间的CO2,其目的是 。
(二)提纯:
(5)粗产品品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后,通过 (填实验操作名称),即可得到PCl3的纯品。
(三)分析:
测定产品中PCl3纯度的方法如下:迅速称取m g产品,水解完全后配成500mL溶液,取出25.00mL加入过量的c1 mol/L V1 mL 碘溶液,充分反应后再用c2 mol/L Na2S2O3溶液滴定过量的碘,终点时消耗V2 mL Na2S2O3溶液。
已知:H3PO3+H2O+I2=H3PO4+2HI;I2+2Na2S2O3=2NaI+Na2S4O6;假设测定过程中没有其他反应。
(6)根据上述数据,该产品中PCl3的质量分数为 (用含字母的代数式表示、不必化简)。
 2Z(g) ΔH<0。当改变某个条件并达到新平衡后,下列叙述正确的是
2Z(g) ΔH<0。当改变某个条件并达到新平衡后,下列叙述正确的是


 2PCl3;2P+5Cl2(过量)
2PCl3;2P+5Cl2(过量) 
