题目内容
 在一个体积为2L的密闭容器中,高温下发生下列反应:
在一个体积为2L的密闭容器中,高温下发生下列反应:Fe(s)+CO2(g)?FeO(s)+CO(g)+Q kJ
其中CO2、CO的物质的量(mol)随时间(min)的变化如图所示.
(1)反应在1min时第一次达到平衡状态,固体的质量增加了6.4g.用CO的浓度变化表示的反应速率υ(CO)=
(2)反应进行至2min时,若只改变一个条件,曲线发生的变化如图所示,3min时再次达到平衡,则Q
(3)5min时再充入一定量的CO(g),平衡发生移动.下列说法正确的是
a.υ(正)先增大后减小
b.υ(正)先减小后增大
c.υ(逆)先增大后减小
d.υ(逆)先减小后增大
表示n(CO2)变化的曲线是
(4)能说明该反应已经达到化学平衡状态的是
a.容器内气体压强不再变化 b.容器内气体的密度不再变化 c.固体的质量不再变化.
考点:反应速率的定量表示方法,化学平衡的影响因素,物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:(1)根据固体质量增加6.4g,求出生成FeO的量,然后求出一氧化碳的变化量及反应速率;
(2)根据新平衡时CO物质的量增加,可判断平衡向正方向移动;
(3)根据浓度变化分析反应速率变化;
(4)平衡时各物质的正逆反应速率相等,各物质的浓度、质量、体积分数以及百分含量不变.
(2)根据新平衡时CO物质的量增加,可判断平衡向正方向移动;
(3)根据浓度变化分析反应速率变化;
(4)平衡时各物质的正逆反应速率相等,各物质的浓度、质量、体积分数以及百分含量不变.
解答:
解:(1)Fe(s)+CO2(g)?FeO(s)+CO(g)中Fe→FeO,固体质量增加6.4g,即增加的氧原子的质量为6.4g,则氧原子的物质的量为0.4mol,说明生成FeO为0.4mol,所以生成的一氧化碳为0.4mol,所以v(CO)=
=0.2mol?L-1?min-1;
故答案为:0.2mol?L-1?min-1;
(2)由于建立新平衡时CO物质的量增加,可知升高温度,平衡正向移动,说明正反应吸热,即△H>0;
平衡常数K=
,由于一氧化碳的浓度增加,二氧化碳的浓度减小,所以平衡常数变大,即K1<K2;
故答案为:>;<;
(3)充入CO,CO浓度增大,逆反应速率增大,之后逐渐减小;5min时CO2浓度不变,正反应速率不变,平衡逆向移动,CO2浓度增大,正反应速率逐渐增大;n(CO2)的物质的量从原平衡曲线逐渐增大;
故答案为:c;b;
(4)a、反应Fe(s)+CO2(g)?FeO(s)+CO(g)是一个反应前后气体体积不变的化学反应,无论该反应是否达到平衡状态,容器中气体压强始终不变,故a错误;
b、ρ=
,容器的体积v不变,气体的质量变化,随反应的进行ρ始终在变化,直到达到平衡为止,故b正确;
c、平衡时各物质的量不变,由于Fe转化为FeO固体的质量增大,所以当达到平衡状态时固体总质量保持不变,故c正确;
故答案为:bc.
| 0.4mol |
| 2L×1min |
故答案为:0.2mol?L-1?min-1;
(2)由于建立新平衡时CO物质的量增加,可知升高温度,平衡正向移动,说明正反应吸热,即△H>0;
平衡常数K=
| c(CO) |
| c(CO2) |
故答案为:>;<;
(3)充入CO,CO浓度增大,逆反应速率增大,之后逐渐减小;5min时CO2浓度不变,正反应速率不变,平衡逆向移动,CO2浓度增大,正反应速率逐渐增大;n(CO2)的物质的量从原平衡曲线逐渐增大;
故答案为:c;b;
(4)a、反应Fe(s)+CO2(g)?FeO(s)+CO(g)是一个反应前后气体体积不变的化学反应,无论该反应是否达到平衡状态,容器中气体压强始终不变,故a错误;
b、ρ=
| m |
| v |
c、平衡时各物质的量不变,由于Fe转化为FeO固体的质量增大,所以当达到平衡状态时固体总质量保持不变,故c正确;
故答案为:bc.
点评:本题考查了化学平衡的影响因素、平衡状态的判断、反应速率的计算等,难度中等.随着反应进行变化的物理量不再变化,说明到达平衡.

练习册系列答案
相关题目
下列关于有机物的说法错误的是( )
| A、乙酸的分子式为CH3COOH,属于弱电解质 |
| B、食醋中含有乙酸,乙酸可由乙醇氧化得到 |
| C、乙醇中是否含有水,可用无水硫酸铜来检验 |
| D、乙醇和乙酸的熔点和沸点都比C2H6、C2H4的熔点和沸点高 |
根据如图的转化关系判断下列说法正确的是(反应条件已略去)( )


| A、反应①②③④⑤均属于氧化还原反应 |
| B、反应⑤说明该条件下铝可用于制熔点较高的金属 |
| C、相同条件下生成等量的O2,反应③和④转移的电子数之比为1:1 |
| D、反应①中氧化剂与还原剂的物质的量之比为1:4 |
 此烃名称为
此烃名称为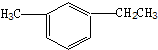 的烃可命名为
的烃可命名为 的烃可命名为:
的烃可命名为: