题目内容
一定温度下,将2mol A2和x mol B2通入体积为2L的密闭容器中发生反应A2(g)+3B2(g)?2AB3(g),当反应达到平衡时,测得AB3的物质的量为2mol,若此反应的平衡常数K=0.25,则x的值是( )
| A、7 | B、8 | C、9 | D、10 |
考点:化学平衡的计算
专题:化学平衡专题
分析:根据平衡时AB3的物质的量为2mol,利用化学平衡三段式求出平衡时各组分的浓度,再根据平衡常数列式计算.
解答:
解:对应反应A2(g)+3B2(g)?2AB3(g),
起始(mol) 2 x 0
变化(mol) 1 3 2
平衡(mol) 1 x-3 2
平衡时A2、B2、AB3的物质的量浓度分别为
=0.5mol/L、
、
=1mol/L,
平衡常数K=
=
=0.25,解得x=7,
故选A.
起始(mol) 2 x 0
变化(mol) 1 3 2
平衡(mol) 1 x-3 2
平衡时A2、B2、AB3的物质的量浓度分别为
| 1mol |
| 2L |
| (x-3)mol |
| 2L |
| 2mol |
| 2L |
平衡常数K=
| c2(AB3) |
| c(A2)?c3(B2) |
| (1mol/L)2 | ||
0.5mol/L×[
|
故选A.
点评:本题考查了化学平衡计算应用,主要是转化率和平衡常数概念的计算应用,掌握基础是关键,题目较简单.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
一定温度下,在三个体积约为1.0L的恒容密闭容器中发生反应:2CH3OH(g)═CH3OCH3(g)+H2O(g)
下列说法正确的是( )
下列说法正确的是( )
| 容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| I | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | ||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
| A、该反应的正方应为吸热反应 |
| B、达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小 |
| C、容器I中反应达到平衡所需时间比容器Ⅲ中的长 |
| D、若起始时向容器I中充入CH3OH 0.1mol、CH3OCH30.15mol和H2O 0.10mol,则反应将向正反应方向进行 |
现有铁粉与Fe2O3组成的混合物m g投入到足量的稀H2SO4中,在标准状况下收集到V L H2,所得溶液遇KSCN溶液不显红色,则混合物中Fe2O3的质量为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
在短周期元素中,原子最外层只有1个或2个电子的元素是( )
| A、金属元素 |
| B、稀有气体 |
| C、非金属元素 |
| D、无法确定为哪一类元素 |
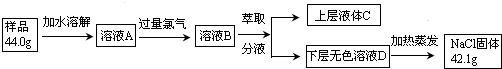
 请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):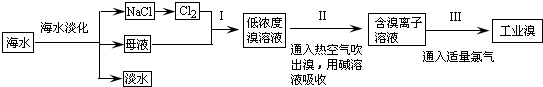
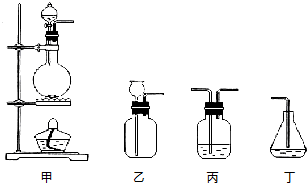
 某同学欲配制100mL 0.10mol/L CuSO4溶液.以下操作1~5是其配制过程及示意图:
某同学欲配制100mL 0.10mol/L CuSO4溶液.以下操作1~5是其配制过程及示意图: