题目内容
现有铁粉与Fe2O3组成的混合物m g投入到足量的稀H2SO4中,在标准状况下收集到V L H2,所得溶液遇KSCN溶液不显红色,则混合物中Fe2O3的质量为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
考点:有关混合物反应的计算,铁的化学性质,铁的氧化物和氢氧化物
专题:几种重要的金属及其化合物
分析:混合物与足量的稀H2SO4反应,所得溶液中加入KSCN溶液,无血红色出现,说明溶液中的溶质为FeSO4,发生反应:Fe+2H+=Fe2++H2↑、Fe+Fe2O3+6H+=3Fe2++3H2O,根据氢气体积计算与反应生成氢气消耗Fe的物质的量,设原混合物中Fe2O3的物质的量分别为xmol,表示出与氧化铁反应Fe的物质的量,结合二者质量之和列方程计算出Fe2O3的物质的量,进而计算其质量.
解答:
解:生成氢气物质的量为:
=
mol,则:
Fe+2H+=Fe2++H2↑
mol
mol
设原混合物中Fe2O3的物质的量为x mol,则:
Fe+Fe2O3+6H+=3Fe2++3H2O
xmol xmol
则:(xmol+
mol)×56g/mol+x mol×160g/mol=mg,
解得:x=
mol,
故混合物中Fe2O3的质量为:
mol×160g/mol=
g,
故选A.
| VL |
| 22.4L/mol |
| V |
| 22.4 |
Fe+2H+=Fe2++H2↑
| V |
| 22.4 |
| V |
| 22.4 |
设原混合物中Fe2O3的物质的量为x mol,则:
Fe+Fe2O3+6H+=3Fe2++3H2O
xmol xmol
则:(xmol+
| V |
| 22.4 |
解得:x=
| m-2.5V |
| 216 |
故混合物中Fe2O3的质量为:
| m-2.5V |
| 216 |
| 20m-50V |
| 27 |
故选A.
点评:本题考查混合物的有关计算,题目难度中等,明确发生的反应是解题关键,侧重考查学生分析解决问题能力,注意氧化铁与盐酸反应、氯化铁与铁的反应两个反应过程利用总反应反应方程式解答,简化了计算过程.

练习册系列答案
相关题目
一定温度下,将2mol A2和x mol B2通入体积为2L的密闭容器中发生反应A2(g)+3B2(g)?2AB3(g),当反应达到平衡时,测得AB3的物质的量为2mol,若此反应的平衡常数K=0.25,则x的值是( )
| A、7 | B、8 | C、9 | D、10 |
各可逆反应达平衡后,改变反应条件,其变化趋势正确的是( )
A、 I2(g)+H2(g)?2HI(g) |
B、 CH3COOH?H++CH3COO-(忽略溶液体积变化) |
C、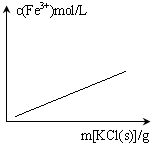 FeCl3+3KSCN?Fe(SCN)3+3KCl(忽略液体体积变化) |
D、 CH3OCH3(g)+3H2O(g)?6H2(g)+2CO(g)-Q(恒压) |
下列原子或离子原子核外电子排布不属于基态排布的是( )
| A、Na:1s22s22p53s2 |
| B、S2-:1s22s22p63s23p6 |
| C、N:1s22s22p3 |
| D、Si:1s22s22p63s23p2 |