题目内容
对反应xR2++yH++O2=mR3++nH2O的离子方程式中,对m和R3+判断正确的是( )
| A、m=4,R3+是氧化产物 | ||
| B、m=y,R3+是还原产物 | ||
| C、m=2,R3+是氧化产物 | ||
D、m=
|
考点:氧化还原反应
专题:氧化还原反应专题
分析:在离子方程式中遵循电荷守恒和原子守恒,化合价升高元素所在的生成物是氧化产物,化合价降低元素所在的生成物是还原产物.
解答:
解:根据氧原子守恒,所以n=2,根据氢原子守恒,所以y=4,
根据R原子守恒则x=m,根据电荷守恒则2x+y=3m,所以x=y=m,则m=4,
在反应中,R的化合价升高,所以R3+是氧化产物,氧元素化合价降低,所以H2O是还原产物.
故选A.
根据R原子守恒则x=m,根据电荷守恒则2x+y=3m,所以x=y=m,则m=4,
在反应中,R的化合价升高,所以R3+是氧化产物,氧元素化合价降低,所以H2O是还原产物.
故选A.
点评:本题考查学生氧化还原反应中的概念和原子守恒知识,把握反应中元素的化合价变化为解答的关键,侧重守恒法应用的考查,题目难度不大.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
下列实验操作中有错误的是( )
| A、蒸馏时,冷凝水应从冷凝管的下口通入、上口流出且将温度计水银球插入液体中 |
| B、分液时,分液漏斗下层液体从下口放出,上层液体也从下口放出 |
| C、萃取时,萃取剂的选取与密度无关 |
| D、蒸发时,当溶液中出现少量固体应停止加热,利用余热蒸干剩余溶液 |
用铝箔包装0.1mol金属钠,用针扎一些小孔,放入水中,完全反应后,用排水取气法收集产生的气体,则收集到气体的为( )
| A、O2和H2的混合气体 |
| B、0.05molH2 |
| C、大于0.05molH2 |
| D、小于0.05molH2气体 |
苹果切开后的剖面在空气中会很快变黄,有人称之为“苹果生锈”.若将维生素C溶液涂在新切开的剖面上,剖面就不会迅速变成黄色.这说明维生素C具有( )
| A、氧化性 | B、还原性 |
| C、碱性 | D、酸性 |
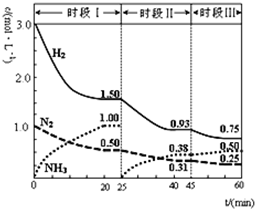 N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1.恒容时,体系中各物质浓度随时间变化的曲线如图示.下列说法正确的是( )
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1.恒容时,体系中各物质浓度随时间变化的曲线如图示.下列说法正确的是( )| A、前20分钟反应内放出的热量为46.2kJ |
| B、第25分钟改变的条件是将NH3从反应体系中分离出去 |
| C、若第60分钟时反应又达到了平衡,则时段Ⅲ改变的条件是增大压强 |
| D、时段Ⅰ仅将初始投放的物质浓度增至原来的2倍,则反应物的转化率增大,平衡常数不变 |
 最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942KJ,根据以上信息和数据,下列说法正确的是( )
最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942KJ,根据以上信息和数据,下列说法正确的是( )| A、N4属于一种新型的化合物 |
| B、N4与N2互为同位素 |
| C、N4与N2互为同素异形体 |
| D、1mol N4气体转变为N2将吸收882kJ热量 |
根据等电子原理,等电子体之间结构相似、物理性质也相近.以下各组粒子不能互称为等电子体的是( )
| A、CO和N2 |
| B、O3和SO2 |
| C、CO2和N2O |
| D、N2H4 和C2H4 |
下列事实得出的结论正确的是( )
| A、某雨水样品放置一段时间,pH由5.6变为4.3,说明水中溶解了更多的CO2 |
| B、用一束强光照射经过煮沸的三氯化铁溶液有光的通路,说明已生成氢氧化铁胶体 |
| C、常温下铜可溶于浓硝酸,铁不溶于浓硝酸,说明铜比铁更活泼 |
| D、二氧化硫溶于水所得的溶液可导电,说明二氧化硫是电解质 |
设NA为阿佛加德罗常数的值,下列说法正确的是( )
| A、25℃时,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
| B、在标准状况下,2.24 L CH2Cl2含有σ键的数目为0.4NA |
| C、某密闭容器盛有0.1molN2与0.3molH2,在一定条件下充分反应生成NH3,转移的电子数为0.6NA |
| D、向沸水中逐滴加入100 mL 0.1 mol/L饱和FeCl3溶液,形成的胶粒数小于0.01NA |