题目内容
 最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942KJ,根据以上信息和数据,下列说法正确的是( )
最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942KJ,根据以上信息和数据,下列说法正确的是( )| A、N4属于一种新型的化合物 |
| B、N4与N2互为同位素 |
| C、N4与N2互为同素异形体 |
| D、1mol N4气体转变为N2将吸收882kJ热量 |
考点:不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构
分析:A.化合物是由不同种元素组成的纯净物,单质是由同种元素组成的纯净物;
B.同位素是质子数相同,中子数不同的原子;
C.同素异形体是同种元素形成的不同单质;
D.根据化学键断裂要吸收热量,形成化学键要放出热量,根据题中数据计算出1molN4转变成N2放出的热量.
B.同位素是质子数相同,中子数不同的原子;
C.同素异形体是同种元素形成的不同单质;
D.根据化学键断裂要吸收热量,形成化学键要放出热量,根据题中数据计算出1molN4转变成N2放出的热量.
解答:
解:A.N4由N组成,是一种单质,故A错误;
B.N4与N2是同种元素形成的不同单质,不是同位素,故B错误;
C.N4与N2是同种元素形成的不同单质,是同素异形体,故C正确;
D.1molN4气体中含有0.6molN-N键,可生成2molN2,形成2molN≡N键,则1moN4气体转变为N2化学键断裂断裂吸收的热量为6×167KJ=1002KJ,形成化学键放出的热量为2×942kJ=1884KJ,所以反应放热,放出的热量为1884KJ-1002KJ=882KJ,故应为放出882KJ热量,故D错误;
故选C.
B.N4与N2是同种元素形成的不同单质,不是同位素,故B错误;
C.N4与N2是同种元素形成的不同单质,是同素异形体,故C正确;
D.1molN4气体中含有0.6molN-N键,可生成2molN2,形成2molN≡N键,则1moN4气体转变为N2化学键断裂断裂吸收的热量为6×167KJ=1002KJ,形成化学键放出的热量为2×942kJ=1884KJ,所以反应放热,放出的热量为1884KJ-1002KJ=882KJ,故应为放出882KJ热量,故D错误;
故选C.
点评:本题考查较为综合,涉及物质的组成和分类以及反应热的计算等问题,题目难度不大,注意基础知识的把握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列反应中,水既不作氧化剂又不作还原剂的氧化还原反应是( )
| A、钠与水反应 |
| B、氧化钠与水反应 |
| C、过氧化钠与水反应 |
| D、二氧化硫与水反应 |
对反应xR2++yH++O2=mR3++nH2O的离子方程式中,对m和R3+判断正确的是( )
| A、m=4,R3+是氧化产物 | ||
| B、m=y,R3+是还原产物 | ||
| C、m=2,R3+是氧化产物 | ||
D、m=
|
下列各组物质中,属于同分异构体的是( )
| A、O2和O3 |
| B、CH2=CHCH2CH3和CH3CH=CHCH3 |
| C、CH3CH2CH3和CH3(CH2)2CH3 |
| D、乙醇和乙醚 |
 短周期元素a、b、c在周期表中位置如图所示,已知三者原子序数之和为27,则a、b、C三种元素的名称是( )
短周期元素a、b、c在周期表中位置如图所示,已知三者原子序数之和为27,则a、b、C三种元素的名称是( )| A、碳、氮、硅 |
| B、氮、氧、磷 |
| C、硼、碳、铝 |
| D、氧、氟、硫 |
 已知:X、Y、Z、W为短周期元素,原子半径X:99pm Y:154pm Z:125pm W:117pm,X、Y、W位置如图所示(副族省略),X、Y、Z的最高价氧化物对应的水化物相互能反应,下列说法正确的是( )
已知:X、Y、Z、W为短周期元素,原子半径X:99pm Y:154pm Z:125pm W:117pm,X、Y、W位置如图所示(副族省略),X、Y、Z的最高价氧化物对应的水化物相互能反应,下列说法正确的是( )| A、元素Z处于周期表的阴影位置 |
| B、X与W形成的化合物熔点很高,为离子化合物 |
| C、X、W的最高价氧化物对应水化物的酸性:X>W |
| D、Y、W的最高价氧化物的晶体类型相同 |
下列离子方程式中书写正确的是( )
| A、FeCl2溶液中通入Cl2 Fe2++Cl2═Fe3++2Cl- |
| B、Al2O3与NaOH溶液反应 Al2O3+2OH-═2[Al(OH)4]- |
| C、FeCl3溶液与铜 Fe3++Cu═Fe2++Cu2+ |
| D、用醋酸除水垢 2CH3COOH+CaCO3═2CH3COO-+Ca2++H2O+CO2↑ |
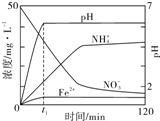 某课题组利用Fe粉和KNO3溶液反应,模拟地下水脱氮过程,探究脱氮原理.
某课题组利用Fe粉和KNO3溶液反应,模拟地下水脱氮过程,探究脱氮原理.