题目内容
18.某同学在做锌与稀硫酸的反应,若稀硫酸足量,现欲加快化学反应速率,但不能影响生成氢气的总量,可采取的措施是( )| A. | 加热 | B. | 滴入数滴硫酸铜溶液 | ||
| C. | 加入少量NaCl溶液 | D. | 加入少量KNO3溶液 |
分析 加快反应速率,可以采用升高温度或增大反应物浓度等方法,但不影响生成物氢气的总量,说明锌不和其它物质反应而影响生成氢气,以此解答该题.
解答 解:A.加热,升高温度,可增大活化分子百分数,增大反应速率,不影响生成氢气的总量,故A正确;
B.加入几滴硫酸铜溶液,锌置换出铜,形成原电池反应,增大反应速率,但消耗锌,生成氢气的总量减少,故B错误;
C.加入氯化钠溶液,浓度减小,反应速率减小,故C错误;
D.硝酸根离子在酸性条件下具有强氧化性,与锌反应不生成氢气,故D错误.
故选A.
点评 本题考查化学反应速率影响因素,为高频考点,注意题干中要求“加快反应速率但不影响氢气总量”是解本题关键,易错选项是D注意硝酸和锌反应不生成氢气,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.下列属于放热反应的是( )
| A. | 焦碳和二氧化碳共热 | B. | 铝和盐酸反应 | ||
| C. | 石灰石的分解 | D. | 氢气还原氧化铜 |
10.铵盐是一类重要的氮的化合物,设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 0.1 mol NH4+含有的电子数为1.1NA | |
| B. | NH4+中N元素的化合价为-3,在氧化还原反应中常作氧化剂 | |
| C. | 0.1 L 3 mol•L-1的NH4NO3溶液中氮原子数等于0.6NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成56gN2时,转移的电子数目为3.75NA |
7.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)>c(NO3-) | |
| B. | 0.1 mol/L NH4Cl溶液:c(NH4+ )=c(Cl-) | |
| C. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 0.1 mol/L Na2CO3溶液:c(Na+)=2[c(HCO3-)+c(CO32-)+c(H2CO3)] |
8.常温下,0.1mol/L HA溶液的pH>1,0.1mol/L BOH溶液中c(OH-)与c(H+)之比为1012,将两溶液等体积混合,以下判断正确的是( )
| A. | HA是一种强酸 | B. | 反应后溶液中c(OH-)<c(H+) | ||
| C. | c(A-)>c(B+)>c(H+)>c(OH-) | D. | 反应后混合溶液中还含有HA分子 |

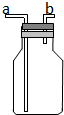 如图所示的装置在实验室种用途比较广泛.
如图所示的装置在实验室种用途比较广泛.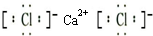 .
.