题目内容
14.已知:(1)某无机高分子混凝剂的化学式可表示为Al2(OH)nClm•yH2O; (2)AgF+Cl2+H2O→AgCl+AgClO3+HF+O2(未配平).则( )| A. | 混凝剂具有强氧化性 | |
| B. | Al2(OH)nClm•yH2O化学式中m等于3-n | |
| C. | 若(2)中Cl2化学计量数为a,则AgF的化学计量数为3a | |
| D. | 若(2)中AgClO3、O2的化学计量数分别为b、c,则AgCl的化学计量数为5b+4c |
分析 A.依据氯元素化合价判断其性质;
B.根据化合物Al2(OH)nClm中正负化合价的代数和为0来计算;
C.根据AgCl和AgClO3可知:银原子与氯原子相等,Cl2的化学计量数为a,故AgCl和AgClO3的化学计量数之和为2a,AgF的化学计量数等于AgCl和AgClO3化学计量数之和;
D.Cl2中由0价升高到+5价,O元素的化合价有-2价升高到0价,Cl的化合价有0价降低到-1价,根据化合价升降总和相等可知:AgCl的化学计量数应等于AgClO3化学计量数的5倍与O2化学计量数的4倍之和.
解答 解:A.Al2(OH)nClm•yH2O,中氯元素化合价为-1价,不具有强的氧化性,故A错误;
B.由化合物Al2(OH)nClm中正负化合价的代数和为0,则(+3)×2+(-1)×n+(-1)×m=0,解得m=6-n,故B错误;
C.根据AgCl和AgClO3可知:银原子与氯原子相等,Cl2的化学计量数为a,故AgCl和AgClO3的化学计量数之和为2a,AgF的化学计量数等于AgCl和AgClO3化学计量数之和,故AgF的化学计量数为2a,故C错误;
D.Cl的化合价由0价升高到+5价,O的化合价有-2价升高到0价,Cl的化合价有0价降低到-1价,根据化合价升降守恒可知:AgCl的化学计量数应等于AgClO3化学计量数的5倍与O2化学计量数的4倍之和,故AgCl的化学计量数为5b+4c,故D正确;
故选:D.
点评 本题考查了氧化还原反应,准确判断元素化合价变化,熟悉氧化还原反应中得失电子守恒、原子个数守恒是解题关键,题目难度中等.

练习册系列答案
 优加精卷系列答案
优加精卷系列答案
相关题目
5.下列过程与加成反应无关的是( )
| A. | 苯与溴水混合振荡,水层颜色变浅 | |
| B. | 乙炔与氢气反应变成乙烷 | |
| C. | 乙烯与水在一定条件下反应制取乙醇 | |
| D. | 乙烯与HCl在一定条件下反应制取氯乙烷 |
9.下列实验错误的是( )
| A. | 加入适量铜粉除去Cu(NO3)2溶液中的Fe(NO3)3杂质 | |
| B. | 在物质提纯操作中不能用乙醇从碘水中萃取碘 | |
| C. | 向Ca(ClO)2溶液中通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 | |
| D. | 向Ca(OH)2溶液中通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失 |
19.下列气体不会造成大气污染的是( )
| A. | SO2 | B. | CO | C. | N2 | D. | NO |
6.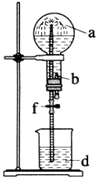 在如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.a和b分别是( )
在如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.a和b分别是( )
 在如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.a和b分别是( )
在如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.a和b分别是( )| a(干燥气体) | b(液体) | |
| A | NO2 | 水 |
| B | CO2 | 水 |
| C | Cl2 | 饱和食盐水 |
| D | NH3 | 水 |
| A. | A | B. | B | C. | C | D. | D |
3.下列叙述正确的是( )
| A. | 1molCO2的质量为44g/mol | |
| B. | H2SO4的摩尔质量为98 | |
| C. | 标准状况下,气体摩尔体积约为22.4L | |
| D. | O2的相对分子质量为32 |
4.下列反应中一定属于吸热反应的是( )
| A. | 需加热或点燃才能引发的反应 | |
| B. | 氧化还原反应 | |
| C. | 氢氧化钡晶体和氯化铵晶体混合搅拌 | |
| D. | 一氧化碳和氧气反应 |