题目内容
10.首次将量子化概念应用到原子结构,并解释了原子的稳定性的科学家是( )| A. | 道尔顿 | B. | 爱因斯坦 | C. | 玻尔 | D. | 卢瑟福 |
分析 玻尔首次将量子化概念应用到原子结构,并解释了原子稳定性量子化的概念,玻尔提出了能级的概念,解释了氢原子的光谱.
解答 解:A.道尔顿提出了近代原子学说,故A错误;
B.爱因斯坦创立了代表现代科学的相对论,故B错误;
C.玻尔首次将量子化概念应用到原子结构,并解释了原子稳定性,故C正确;
D.卢瑟福提出放射性半衰期的概念,故D错误.
故选C.
点评 本题主要考查了化学史,难度不大,平时注意知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列盛液体的仪器加热时,不需要用石棉网的是( )
| A. | 锥形瓶 | B. | 蒸馏烧瓶 | C. | 烧杯 | D. | 蒸发皿 |
15.氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.请回答下列问题.
(1)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为配位键,该化学键能够形成的原因是CN-能提供孤对电子,Fe3+能接受孤对电子(或Fe3+有空轨道).
(2)已知:
分析上表中四种物质的相关数据,请回答:
①CH4和SiH4比较,沸点高低的原因是:结构相似时,相对分子质量越大,分子间作用力越大,因此CH4的沸点低于SiH4.
②NH3和PH3比较,沸点高低的原因是:NH3分子间还存在氢键作用,因此NH3的沸点高于PH3.
(1)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为配位键,该化学键能够形成的原因是CN-能提供孤对电子,Fe3+能接受孤对电子(或Fe3+有空轨道).
(2)已知:
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
①CH4和SiH4比较,沸点高低的原因是:结构相似时,相对分子质量越大,分子间作用力越大,因此CH4的沸点低于SiH4.
②NH3和PH3比较,沸点高低的原因是:NH3分子间还存在氢键作用,因此NH3的沸点高于PH3.
19.下列说法中正确的是( )
| A. | HCO3- 在水溶液中只电离,不水解 | B. | 硝酸钠溶液水解后呈中性 | ||
| C. | 可溶性的铝盐都能发生水解反应 | D. | 可溶性的钠盐都不发生水解反应 |
 )与苯的真实结构不相符的是BCD.
)与苯的真实结构不相符的是BCD. .
.
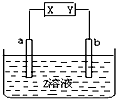 用如图所示电解装置分别完成以下要求,请填空:
用如图所示电解装置分别完成以下要求,请填空: