题目内容
将6.5g锌投入200mL一定浓度的盐酸中,锌和盐酸恰好完全反应.
求:(1)反应中生成的H2的质量
(2)生成的H2在标准状况下的体积.
求:(1)反应中生成的H2的质量
(2)生成的H2在标准状况下的体积.
考点:化学方程式的有关计算
专题:计算题
分析:根据锌与盐酸恰好完全反应,将锌的物质的量代入锌与盐酸反应的化学方程式可计算氢气的物质的量,然后计算氢气的质量和在标准状况下的体积.
解答:
解:锌的物质的量为
=0.1mol,
设生成氢气的物质的量为x,则
Zn+2HCl═ZnCl2+H2↑
1 1
0.1mol x
=
,解得x=0.1mol,
(1)生成H2的质量为0.1mol×2g/mol=0.2g,答:生成H2的质量为0.2g;
(2)生成标准状况下的H2的体积为0.1mol×22.4L/mol=2.24L,答:生成标准状况下的H22.24L.
| 6.5g |
| 65g/mol |
设生成氢气的物质的量为x,则
Zn+2HCl═ZnCl2+H2↑
1 1
0.1mol x
| 1 |
| 1 |
| 0.1 |
| x |
(1)生成H2的质量为0.1mol×2g/mol=0.2g,答:生成H2的质量为0.2g;
(2)生成标准状况下的H2的体积为0.1mol×22.4L/mol=2.24L,答:生成标准状况下的H22.24L.
点评:本题考查学生利用化学反应方程式的计算,明确锌的量代入化学反应方程式是计算的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
将200ml 0.5mol/L 的 BaCl2 溶液和 300ml 0.2mol/L 的 CaCl2溶液混合,得到 500ml 混合液,其中 Cl- 的浓度是( )
| A、0.9 mol/L |
| B、0.64 mol/L |
| C、0.5 mol/L |
| D、0.32 mol/L |
关于“物质的量”叙述正确的是( )
| A、单位:g.mol-1 |
| B、七个基本物理量之一 |
| C、用来描述微观粒子的质量 |
| D、数值是:6.02×1023 |
常温常压下,2.2g CO2气体的摩尔质量是( )
| A、0.05 g/mol |
| B、0.5 mol |
| C、44 g |
| D、44 g/mol |
下列物质中含有原子数由多到少排列正确的是( )
①0.1mol H2SO4 ②4.8g氢气 ③5.6L标准状况下NH3 ④4℃时5.4mL H2O.
①0.1mol H2SO4 ②4.8g氢气 ③5.6L标准状况下NH3 ④4℃时5.4mL H2O.
| A、①>②>③>④ |
| B、②>③>④>① |
| C、②>①>③>④ |
| D、③>①>④>② |
浊液区别于其他分散系最本质的特征是( )
| A、外观混浊不清 |
| B、分散质粒子不能透过半透膜 |
| C、不稳定 |
| D、分散质粒子直径大于100 nm |
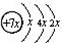 .B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
.B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题: