题目内容
为了探究氯水的成份,某学生在氯水中分别加入下列物质,请按要求回答问题:
(1)紫色石蕊试液 写出实验的现象)
(2)Na2CO3溶液 写出离子方程式)
(3)HNO3酸化的AgNO3溶液 写出离子方程式)
(4)NaOH溶液 写出化学方程式)
(1)紫色石蕊试液
(2)Na2CO3溶液
(3)HNO3酸化的AgNO3溶液
(4)NaOH溶液
考点:氯气的化学性质
专题:卤族元素
分析:氯气溶于水发生反应生成氯化氢和次氯酸,氯化氢为强电解质电离产生氢离子与氯离子,次氯酸电离产生氢离子和次氯酸根离子,次氯酸具有漂白性,据此解答.
解答:
解:(1)氯气溶于水发生反应生成氯化氢和次氯酸,氯化氢溶于水电离产生氢离子溶液显酸性,而生成的次氯酸具有漂白性,所以加入紫色石蕊试液后会看到:溶液先变红后褪色;
故答案为:溶液先变红后褪色;
(2)氯水中含有盐酸,盐酸与碳酸钠溶液反应的离子方程式为:CO32-+2H+=H2O+CO2↑;
故答案为:CO32-+2H+=H2O+CO2↑;
(3)氯气溶于水发生反应生成氯化氢和次氯酸,氯化氢为强电解质电离产生氢离子与氯离子,加入HNO3酸化的AgNO3溶液发生反应的离子方程式为:Ag++Cl-=AgCl↓;
故答案为:Ag++Cl-=AgCl↓;
(4)氯水中含有氯气、盐酸、次氯酸,均能与氢氧化钠发生反应,发生反应的化学方程式为:Cl2+2NaOH═NaCl+NaClO+H2O、HCl+NaOH=H2O+NaCl、HClO+NaOH=H2O+NaClO;
故答案为:Cl2+2NaOH═NaCl+NaClO+H2O、HCl+NaOH=H2O+NaCl、HClO+NaOH=H2O+NaClO.
故答案为:溶液先变红后褪色;
(2)氯水中含有盐酸,盐酸与碳酸钠溶液反应的离子方程式为:CO32-+2H+=H2O+CO2↑;
故答案为:CO32-+2H+=H2O+CO2↑;
(3)氯气溶于水发生反应生成氯化氢和次氯酸,氯化氢为强电解质电离产生氢离子与氯离子,加入HNO3酸化的AgNO3溶液发生反应的离子方程式为:Ag++Cl-=AgCl↓;
故答案为:Ag++Cl-=AgCl↓;
(4)氯水中含有氯气、盐酸、次氯酸,均能与氢氧化钠发生反应,发生反应的化学方程式为:Cl2+2NaOH═NaCl+NaClO+H2O、HCl+NaOH=H2O+NaCl、HClO+NaOH=H2O+NaClO;
故答案为:Cl2+2NaOH═NaCl+NaClO+H2O、HCl+NaOH=H2O+NaCl、HClO+NaOH=H2O+NaClO.
点评:本题考查了氯水的性质,明确氯水的成分是解题关键,注意次氯酸具有漂白性.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列溶液里离子检验的结论正确的是( )
| A、加稀盐酸产生无色无味气体,将气体通入澄清石灰水,石灰水变浑浊,原溶液可能含CO32- |
| B、加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀消失,原溶液一定含有SO42- |
| C、加入AgNO3溶液有白色沉淀产生,原溶液一定含有Cl- |
| D、加入Na2CO3溶液有白色沉淀产生,再加盐酸,白色沉淀消失,原溶液中一定含有Ba2+ |
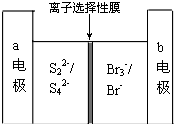 下图是一种正在投入生产的大型蓄电系统的原理图.电池的中间为只允许钠离子通过的离子选择性膜.电池充、放电的总反应方程式为:2Na2S2+NaBr3
下图是一种正在投入生产的大型蓄电系统的原理图.电池的中间为只允许钠离子通过的离子选择性膜.电池充、放电的总反应方程式为:2Na2S2+NaBr3| 放电 |
| 充电 |
Na2S4+3NaBr下述关于此电池说法正确的是( )
| A、充电的过程中当0.1mol Na+通过离子交换膜时,导线通过0.1mol电子 |
| B、电池放电时,负极反应为:3NaBr-2e═NaBr3+2Na |
| C、充电过程中,电极a与电源的正极相连 |
| D、放电过程中钠离子从右到左通过离子交换膜 |

 可导致患者出现头痛、恶心等症状,需静脉注射小苏打(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解.写出水杨酸与小苏打反应的化学方程式:
可导致患者出现头痛、恶心等症状,需静脉注射小苏打(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解.写出水杨酸与小苏打反应的化学方程式: