题目内容
(1)某温度下体积为100L的氨合成塔中(已知合成氨的反应为放热反应),测得各物质浓度(mol/L)的变化如下表:根据表中数据计算0h~2h内N2的平均反应速率为 .请用下表中适当的数据表示该反应的平衡常数表达式: .
(2)反应在4h~5h之间,平衡向正方向移动,可能的原因是 (选填A~F,下同)表中5h~6h之间数值发生变化,可能的原因是 .
A.移走了氨气 B.降低温度 C.加压
D.增加氢气浓度 E.升高温度 F.增加氮气浓度.
| 时间/h | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| N2 | 1.500 | 1.400 | 1.200 | a | a | 0.900 | |
| H2 | 4.500 | 4.200 | 3.600 | b | b | 2.700 | 2.100 |
| NH3 | 0 | 0.200 | 0.600 | c | c | 0.200 | 0.600 |
A.移走了氨气 B.降低温度 C.加压
D.增加氢气浓度 E.升高温度 F.增加氮气浓度.
考点:化学平衡的影响因素,反应速率的定量表示方法
专题:化学平衡专题
分析:(1)根据v=
计算v(N2);根据平衡常数的定义进行书写;
(2)减小生成物浓度,平衡正向移动;增大反应物浓度,平衡正向移动;降低温度,平衡向着放热的方向移动.
| △c |
| △t |
(2)减小生成物浓度,平衡正向移动;增大反应物浓度,平衡正向移动;降低温度,平衡向着放热的方向移动.
解答:
解:(1)由表可知氮气的起始浓度为1.5mol/L,2小时时氮气的浓度为1.2mol/L.所以2小时内氮气的速率为v(N2)=
=0.15mol?L-1?h-1;N2(g)+3H2(g)?2NH3(g),由图中数据可知,3和4h时数据相同,故达到平衡状态,故K=
=
,
故答案为:0.15mol?L-1?h-1;K=
=
;
(2)由数据可知:反应在4h~5h之间,平衡正向移动后,氨气的浓度却降低了,故可能的原因是移走了氨气;由数据可知:反应在5h~6h之间数值发生变化,氢气的浓度减小,氨气的浓度增大,说明平衡正向移动,故可能的原因是降温或增大氮气的浓度,
故答案为:A;BF.
| 1.5-1.2 |
| 2 |
| c2(NH3) |
| c(N2)?c3(H2) |
| c2 |
| a?b3 |
故答案为:0.15mol?L-1?h-1;K=
| c2(NH3) |
| c(N2)?c3(H2) |
| c2 |
| a?b3 |
(2)由数据可知:反应在4h~5h之间,平衡正向移动后,氨气的浓度却降低了,故可能的原因是移走了氨气;由数据可知:反应在5h~6h之间数值发生变化,氢气的浓度减小,氨气的浓度增大,说明平衡正向移动,故可能的原因是降温或增大氮气的浓度,
故答案为:A;BF.
点评:本题考查化学反应速率的计算、平衡常数的表示方法、平衡移动的影响因素等,浓度中等.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、物质的量是衡量物质质量大小的物理量 |
| B、摩尔质量即相对分子质量 |
| C、摩尔是物质的量的单位 |
| D、气体摩尔体积是指单位物质的量的物质所占的体积 |
下列关于有机化合物的说法正确的是( )
A、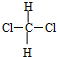 和 和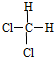 是两种不同的物质 是两种不同的物质 |
| B、淀粉和纤维素水解最终产物都是葡萄糖 |
| C、丁烷有2种同分异构体 |
| D、淀粉、纤维素、蛋白质、油脂都属于天然高分子化合物 |
用四氯化碳萃取碘水中的碘,下列说法中不正确的是( )
| A、实验中使用的主要仪器是普通漏斗、烧杯、铁架台(带铁圈) |
| B、碘在四氯化碳中的溶解度比在水中的溶解度大 |
| C、碘的四氯化碳溶液呈紫色 |
| D、分液时,水层从分液漏斗下口放出,碘的四氯化碳溶液从分液漏斗上口倒出 |
