题目内容
将铁、铝的混合物加入到足量的NaOH溶液中,使之充分反应后过滤,再将过滤得到的固体加入到足量的CuSO4溶液中,充分反应后过滤得到的固体质量恰好与原固体质量相等,则原固体中铁的质量分数为( )
| A、87.5% |
| B、12.5% |
| C、14.3% |
| D、85.7% |
考点:有关混合物反应的计算
专题:
分析:将铁、铝的混合物加入到足量的NaOH溶液中,参加反应的为Al,反应后固体为Fe;充分反应后过滤,再将过滤得到的固体加入到足量的CuSO4溶液中,铁与铜离子反应生成亚铁离子和金属铜,充分反应后过滤得到的固体质量恰好与原固体质量相等,说明反应后生成的铜与混合物Fe和Al的质量相等,根据反应计算出混合物中铁的质量,然后计算出铁的质量分数.
解答:
解:假设原混合物质量为m克,所以经过两次反应后,最终得到的Cu的质量也是m克,设混合物中Fe的质量为xg,则:
Fe+CuSO4═FeSO4+Cu
56 64
x m
x=
=
,
即混合物中Fe的质量为:
g,
所以混合物中Fe的质量分数为:
×100%=87.5%,
故选A.
Fe+CuSO4═FeSO4+Cu
56 64
x m
x=
| 56m |
| 64 |
| 7m |
| 8 |
即混合物中Fe的质量为:
| 7m |
| 8 |
所以混合物中Fe的质量分数为:
| ||
| mg |
故选A.
点评:本题考查了混合物反应的计算,根据题干信息明确反应原理、得出反应生成铜的质量=m(Al)+m(Cu)为解答关键,注意把握好混合物计算的方法与技巧.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
检验小苏打粉末中是否有苏打的方法是( )
| A、溶于水,加Ca(OH)2溶液 |
| B、溶于水,加稀CaCl2溶液 |
| C、加稀盐酸 |
| D、溶于水,加入NaOH溶液 |
对于药品的使用和作用下列说法不正确的是( )
| A、R表示处方药,OTC表示非处方药 |
| B、毒品就是有毒的药品 |
| C、我国明代医学家李时珍所著的医学名著是《神农本草经》 |
| D、麻黄碱是国际奥委会严格禁止使用的兴奋剂 |
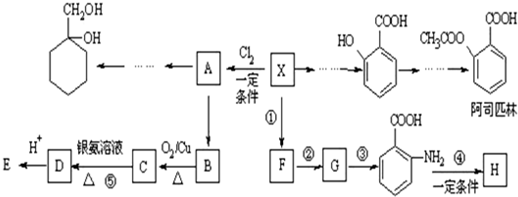
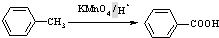
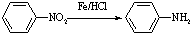 (苯胺,易被氧化)
(苯胺,易被氧化)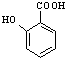 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有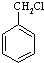 和其他无机物合成
和其他无机物合成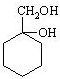 最合理的方案(不超过4步),请在答题纸的方框中表示.例:
最合理的方案(不超过4步),请在答题纸的方框中表示.例: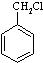
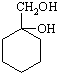


 下列制取气体的方案,可以直接采用如图所示装置进行的是
下列制取气体的方案,可以直接采用如图所示装置进行的是