题目内容
13.在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:C(s)+H2O(g)?CO(g)+H2(g),若该化学平衡状态从正反应开始建立,达到平衡后,给平衡体系加压(缩小容积、其他条件不变),则容器内气体的平均相对分子质量将( )| A. | 增大 | B. | 减小 | C. | 不变 | D. | 不能确定 |
分析 反应是正向达到平衡状态,利用极值法分析,若假设气体全部是生成的CO(g)+H2(g),气体物质的量之比为1:1,平均摩尔质量$\frac{28+2}{2}$mol/L=15g/mol,若全部逆向进行,得到气体为水蒸气摩尔质量为18g/mol,若平衡逆向进行,平均摩尔质量增大;
解答 解:反应是正向达到平衡状态,若假设气体全部是生成的CO(g)+H2(g),气体物质的量之比为1:1,平均摩尔质量$\frac{28+2}{2}$mol/L=15g/mol,若全部逆向进行,得到气体为水蒸气摩尔质量为18g/mol,若平衡逆向进行,平均摩尔质量增大,给平衡体系加压是缩小容积、其他条件不变平衡逆向向进行,平均摩尔质量增大,故选A.
点评 本题考查了化学平衡影响因素的分析,主要是摩尔质量的变化判断方法,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
2.著名的“侯氏制碱法”的第一步反应是向饱和食盐水中通入CO2而析出NaHCO3,该反应可表示为:NH3+NaCl+CO2+H2O═NaHCO3↓+NH4Cl
已知NaCl、NaHCO3、NH4Cl如下温度的溶解度:
今在40℃时,向434g饱和食盐水中通入44.8L(标准状况)NH3,再向溶液中通入过量的CO2,求:
(1)可析出NaHCO3多少克?
(2)NH4Cl能否析出?
(3)若降温至10℃,可析出NH4Cl多少克?
(4)降温至10℃时,若要析出更多的NH4Cl晶体应采取什么措施?
已知NaCl、NaHCO3、NH4Cl如下温度的溶解度:
| 物质 | NaCl | NaHCO3 | NH4Cl |
| 40℃时溶解度/g | 37 | 13 | 46 |
| 10℃时溶解度/g | 33 |
(1)可析出NaHCO3多少克?
(2)NH4Cl能否析出?
(3)若降温至10℃,可析出NH4Cl多少克?
(4)降温至10℃时,若要析出更多的NH4Cl晶体应采取什么措施?
3.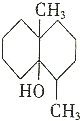 当天空降雨时,雨水会刺激土壤释放出一种称为土臭素的化学物质,其结构简式如图所示.下列试剂(可加热)不与土臭素反应的是( )
当天空降雨时,雨水会刺激土壤释放出一种称为土臭素的化学物质,其结构简式如图所示.下列试剂(可加热)不与土臭素反应的是( )
 当天空降雨时,雨水会刺激土壤释放出一种称为土臭素的化学物质,其结构简式如图所示.下列试剂(可加热)不与土臭素反应的是( )
当天空降雨时,雨水会刺激土壤释放出一种称为土臭素的化学物质,其结构简式如图所示.下列试剂(可加热)不与土臭素反应的是( )| A. | 金属钠 | B. | 醋酸和浓硫酸的混合溶液 | ||
| C. | 酸性高锰酸钾溶液 | D. | 碳酸钠溶液 |
18.下列关于官能团的说法,正确的是( )
| A. | 苯及其同系物没有官能团 | B. | 卤代烃没有官能团 | ||
| C. | 醛的官能团为羰基 | D. | 羧酸和酯的官能团相同 |
5.关于重结晶的说法,错误的是( )
| A. | 被重结晶提纯的物质的溶解度随温度变化大 | |
| B. | 溶解度很小的杂质留在了热滤的滤渣里 | |
| C. | 重结晶的步骤为:加热溶解、冷却过滤、结晶 | |
| D. | 重结晶的首要工作是选择适当的溶剂 |
2.99℃时,Kw=1.0×10-12,该温度下测得0.1mol/LNa2A溶液的pH=6.下列说法不正确的是( )
| A. | H2A在水溶液中的电离方程式为H2A=2H++A2- | |
| B. | 该温度下,将0.01mol/L的H2A溶液稀释20倍后溶液的pH=3 | |
| C. | 体积相同,pH均为1的盐酸和H2A溶液分别与足量的Zn反应,产生H2较多的是H2A | |
| D. | 将0.1mol/L的H2A溶液与0.2mol/L的氨水等体积混合后,溶液中浓度最大的离子是NH4+ |
3.如图是Cu-Zn原电池的装置示意图,下列叙述正确的是( )
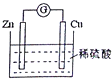

| A. | Zn片是正极 | |
| B. | 电池工作时,H+在铜片上得电子 | |
| C. | 电池工作时,电能转变为化学能,且锌片逐渐被消耗 | |
| D. | 电池工作时,电子从锌片通过硫酸溶液流向铜片 |
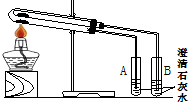 (1)为比较Na2CO3和NaHCO3的热稳定性,某同学设计了如下实验装置.实验时,先检查装置的气密性,再取少量Na2CO3粉末加在大试管的底部,另取少量NaHCO3粉末加在小试管底部.预热后在大试管底部加热.
(1)为比较Na2CO3和NaHCO3的热稳定性,某同学设计了如下实验装置.实验时,先检查装置的气密性,再取少量Na2CO3粉末加在大试管的底部,另取少量NaHCO3粉末加在小试管底部.预热后在大试管底部加热.