题目内容
某溶液有Cl-、CO
、SO
,要求依次检验出这三种离子,请完成下列实验设计:
2- 3 |
2- 4 |
| 检验离子 | 所加试剂 | 实验现象 | 离子方程式 | ||
(1)CO
|
稀硝酸 | ||||
(2)SO
|
产生白色沉淀 | ||||
| (3)Cl- | 产生白色沉淀 |
考点:常见阴离子的检验
专题:物质检验鉴别题,离子反应专题
分析:用三种试剂将三种离子检验出来,每加一种试剂能够检验出一种离子,此时要注意每加入一种试剂只能与一种离子结合,检验Cl-可以使用银离子,检验SO42-离子可以使用钡离子,检验CO3 2-离子可以使用氢离子,而银离子和钡离子都可以与碳酸根离子结合成沉淀,所以需先检验CO3 2-离子,此时可以加入稀硝酸;检验氯离子所用的银离子可以与硫酸根离子结合成微溶于水的硫酸银,所以需先检验硫酸根离子,此时可以加入硝酸钡,最后检验氯离子,可以加入硝酸银,注意检验离子时其他离子的干扰作用,据此进行解答.
解答:
解:检验Cl-可以使用银离子,检验SO42-离子可以使用钡离子,检验CO3 2-离子可以使用氢离子,检验时需要排除干扰离子,应该先检验CO3 2-离子,然后检验SO42-,最后检验Cl-,
(1)需先检验CO32-离子,此时可以加入稀硝酸,会产生无色气泡,反应的离子方程式为:CO32-+2H+=H2O+CO2↑,
故答案为:无色气泡;CO32-+2H+=H2O+CO2↑;
(2)检验SO42-离子可以用含有Ba2+的盐或者是氢氧化钡,反应现象为产生白色沉淀,反应的离子方程式为:Ba2++SO42-=BaSO4↓,
故答案为:硝酸钡;Ba2++SO42-=BaSO4↓;
(3)检验Cl-离子可以使用Ag+,选用硝酸银溶液,反应会生成白色沉淀,反应的离子方程式为:Ag++Cl-=AgCl↓,故答案为:硝酸银;Ag++Cl-=AgCl↓.
(1)需先检验CO32-离子,此时可以加入稀硝酸,会产生无色气泡,反应的离子方程式为:CO32-+2H+=H2O+CO2↑,
故答案为:无色气泡;CO32-+2H+=H2O+CO2↑;
(2)检验SO42-离子可以用含有Ba2+的盐或者是氢氧化钡,反应现象为产生白色沉淀,反应的离子方程式为:Ba2++SO42-=BaSO4↓,
故答案为:硝酸钡;Ba2++SO42-=BaSO4↓;
(3)检验Cl-离子可以使用Ag+,选用硝酸银溶液,反应会生成白色沉淀,反应的离子方程式为:Ag++Cl-=AgCl↓,故答案为:硝酸银;Ag++Cl-=AgCl↓.
点评:本题考查了常见离子的检验方法,题目难度中等,注意掌握常见离子的性质及检验方法,在检验离子存在时必须排除干扰离子,确保检验方案的严密性,如本题中检验硫酸根离子时不能加入氯化钡,否则干扰下一步氯离子的检验.

练习册系列答案
相关题目
用等体积的0.1mol?Lˉ1的BaCl2 溶液,可使相同体积的Fe2(SO4 )3、Na2SO4、MgSO4三种溶液中的SO42ˉ完全沉淀,则三种硫酸盐的物质的量浓度之比为( )
| A、1:3:3 |
| B、3:1:2 |
| C、3:2:3 |
| D、1:1:3 |
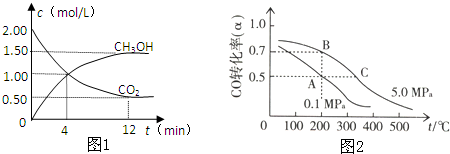
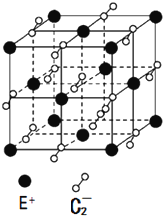 A、B、C、D、E都是元素周期表中的前20号元素,它们的原子序数依次递增.已知B、D两种元素原子的最外层电子数是最内层电子数的两倍,而C元素原子的最外层电子数等于B元素原子的核外电子数,E的价电子数为1.回答下列问题.
A、B、C、D、E都是元素周期表中的前20号元素,它们的原子序数依次递增.已知B、D两种元素原子的最外层电子数是最内层电子数的两倍,而C元素原子的最外层电子数等于B元素原子的核外电子数,E的价电子数为1.回答下列问题.
 (1)金属铝是一种常见的金属,铝-海水-空气电池在航海中得到广泛的应用,写出该电池的正极反应方程式:
(1)金属铝是一种常见的金属,铝-海水-空气电池在航海中得到广泛的应用,写出该电池的正极反应方程式: