题目内容
有关KClO3+6HCl=KCl+3Cl2↑+3H2O的反应,下列说法正确的是( )
| A、被氧化的元素原子个数与被还原的元素原子之比为6:1 |
| B、还原产物与氧化产物的质量之和为287.5g |
| C、KClO3失去6mol电子,HCl得到6mol电子 |
| D、ClO3-和Cl-在酸性环境中可能不能共存 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:由KClO3+6HCl=KCl+3Cl2↑+3H2O可知,KClO3中Cl元素的化合价由+5价降低为0,HCl中Cl元素的化合价由-1价升高为0,该反应转移5e-,以此来解答.
解答:
解:A.由电子守恒和原子守恒可知,HCl中Cl被氧化,KClO3中Cl被还原,则被氧化的元素原子个数与被还原的元素原子之比为5:1,故A错误;
B.还原产物与氧化产物均为氯气,参加反应的量、转移电子数未知,不能计算,故B错误;
C.KClO3得到电子,HCl失去电子,得失电子守恒,故C错误;
D.ClO3-和Cl-在酸性环境中发生氧化还原反应生成氯气,不能共存,故D正确;
故选D.
B.还原产物与氧化产物均为氯气,参加反应的量、转移电子数未知,不能计算,故B错误;
C.KClO3得到电子,HCl失去电子,得失电子守恒,故C错误;
D.ClO3-和Cl-在酸性环境中发生氧化还原反应生成氯气,不能共存,故D正确;
故选D.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应中基本概念及转移电子的考查,注意从化合价角度分析,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列说法正确的是( )
| A、电解NaOH溶液时,溶液浓度将减小,pH增大 |
| B、电解H2SO4溶液时,溶液浓度将增大,pH减小 |
| C、电解Na2SO4溶液时,溶液浓度将增大,pH变大 |
| D、电解NaCl溶液时,溶液浓度将减小,pH不变 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、能使酚酞变红的溶液:Na+、Ba2+、NO3-、Cl- |
| B、含有0.1mol?L-1 Fe3+的溶液中:K+、Mg2+、I-、SO42- |
| C、能溶解Al(OH)3的溶液:NH4+、K+、SO42-、HCO3- |
| D、c(Al3+)=0.5mol?L-1的溶液中:Na+、K+、[Al(OH)4]-、SO42- |
下列反应中,盐酸作为氧化剂的是( )
| A、Zn+2HCl═ZnCl2+H2↑ | ||||
| B、FeS+2HCl═FeCl2+H2S↑ | ||||
| C、NH3+HCl═NH4Cl | ||||
D、MnO2+4HCl
|
 W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )
W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )| A、Y、W的最简单氢化物的水溶液都呈酸性 |
| B、X、Y与Z中的任意两种元素均可形成两种或两种以上的化合物 |
| C、上述四种元素形成的化合物都抑制水的电离 |
| D、W的单质可从Z的最简单氢化物中置换出Z的单质 |
下列离子方程式正确的是( )
| A、碳酸钙加入稀盐酸中:CO32-+H+═H2O+CO2↑ |
| B、硫酸铜溶液与氢氧化钡溶液混合:Ba2++20H-+SO42-+Cu2+═BaSO4↓+Cu(OH)2+ |
| C、硝酸银溶液中加入铜粉:Ag++Cu═Ag+Cu2+ |
| D、铁粉加入稀盐酸中:2Fe+6H+═3H2↑+2Fe3+ |
下列说法不正确的是( )
| A、化学反应的速率越大,化学反应的限度越大 |
| B、化学反应中既有物质变化,又有能量变化 |
| C、化学反应的实质是旧键的断裂,新键的形成 |
| D、可逆反应达到化学平衡状态,反应依然在进行 |
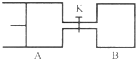 如图所示,向A和B中都充入2mol X和2mol Y,起始时VA=0.8aL,VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应X(g)+Y(g)?2Z(g)+W(g)△H<0,达到平衡时,VA=0.9aL,则下列说法错误的是( )
如图所示,向A和B中都充入2mol X和2mol Y,起始时VA=0.8aL,VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应X(g)+Y(g)?2Z(g)+W(g)△H<0,达到平衡时,VA=0.9aL,则下列说法错误的是( )| A、两容器中达到平衡的时间A<B |
| B、A容器中X的转化率为25%,且比B容器中X的转化率小 |
| C、打开K一段时间达到平衡时,A的体积为0.8aL(连通管中气体体积不计) |
| D、打开K达到新平衡后,升高B容器温度,A容器体积一定减小 |
 金属镍及其化合物在能源、材料等工业中都有重要用途.
金属镍及其化合物在能源、材料等工业中都有重要用途.