题目内容
8.下列各组中属于同位素关系的是( )| A. | ${\;}_{19}^{40}$K与${\;}_{20}^{40}$Ca | B. | T2O与 H2O | ||
| C. | ${\;}_{19}^{40}$K与${\;}_{19}^{39}$K | D. | 石墨和碳纳米管 |
分析 质子数相同,中子数不同是同一元素的不同核素,互为同位素,同位素的分析对象为原子.
A.两者是两个不同的核素;
B.两者是同一种化合物;
C.两者互为同位素;
D.是同一元素组成的不同单质,是互为同素异形体.
解答 解:A.质子数分别为19、20两者不同,为不同元素的原子,不是同位素关系,故A不选;
B.T2O与 H2O均为化合物,且为同种物质水,故B不选;
C.质子数均为19,中子数分别为21、20,则二者互为同位素,故C选;
D.石墨和碳纳米管均为单质,为碳的同素异形体,故D不选;
故选C.
点评 本题考查同位素的判断,为基础性习题,把握同位素的分析对象为原子为解答的关键,注意相关概念的辨析,题目较简单.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
18.下列有关实验操作或现象描述正确的是( )
| A. | 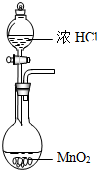 实验室用如图装置制备Cl2 | B. |  加热如图中溶液,溶液变为红色 | ||
| C. |  如图装置可除去Cl2中少量HCl | D. | 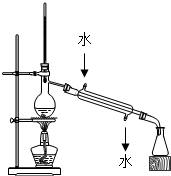 用如图装置制取蒸馏水 |
19.某含有铝电极的原电池工作时,电子从铝电极上流出,下列有关该电池另一电极的材料与电解质溶液的说法中肯定错误的是( )
| A. | 镁、NaOH溶液 | B. | 铜、稀硫酸 | C. | 铜、浓硝酸 | D. | 铁、CuCl2溶液 |
16.X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如下所示.若X 最高正价与负价代数和为O,下列说法中不正确的是( )
| X | Y | |
| Z | W |
| A. | 元素X 形成化合物种类最多 | |
| B. | 元素Y 可形成两种互为同素异形体的单质 | |
| C. | 元素Z 最高价氧化物可干燥H2、O2等气体 | |
| D. | 元素W最高化合价为+7,且其单质具有漂白性 |
3.在标准状况下有:①6.72LCH4②3.01x1023个HCl分子③13.6克H2S ④0.2molNH3
下列对这四种气体的描述正确的是( )
a.体积②>③>①>④
b.密度②>③>④>①
c.质量②>③>①>④
d.氢原子个数①>③>④>②
下列对这四种气体的描述正确的是( )
a.体积②>③>①>④
b.密度②>③>④>①
c.质量②>③>①>④
d.氢原子个数①>③>④>②
| A. | abc | B. | bcd | C. | abd | D. | abcd |
13.如图是元素周期表的一部分,下列说法正确的是( )


| A. | 离子半径:W->X+>Y3- | |
| B. | 可在灰色区域“甲”中寻找催化剂 | |
| C. | 气态氢化物的稳定性:Z>W | |
| D. | 工业上电解 X和 W化合物的水溶液制备 X |
20.下列说法正确的是( )
| A. | 硅是构成岩石和许多矿物的基本元素 | |
| B. | 工艺师利用盐酸刻蚀石英制作艺术品 | |
| C. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| D. | 二氧化硅的化学性质很不活泼,不能与强碱反应生成盐 |
18.现有乙醛(CH3CHO)、乙酸、乙烯和丙烯(C3H6)的混合物,其中氧的质量分数为α,则碳的质量分数是( )
| A. | $\frac{(1-α)}{7}$ | B. | $\frac{6}{7}(1-α)$ | C. | $\frac{12}{13}(1-α)$ | D. | α |
