题目内容
19.某含有铝电极的原电池工作时,电子从铝电极上流出,下列有关该电池另一电极的材料与电解质溶液的说法中肯定错误的是( )| A. | 镁、NaOH溶液 | B. | 铜、稀硫酸 | C. | 铜、浓硝酸 | D. | 铁、CuCl2溶液 |
分析 某含有铝电极的原电池工作时,电子从铝电极上流出吗,则金属铝是负极,正极材料的活泼性比金属铝弱,电解质和金属铝之间可以发生自发氧化还原反应即可.
解答 解:含有铝电极的原电池工作时,电子从铝电极上流出吗,则金属铝是负极,正极材料的活泼性比金属铝弱,电解质和金属铝之间可以发生自发氧化还原反应.
A.镁、Al、NaOH溶液能够成原电池,金属铝是负极,故A正确;
B.铜、铝、稀硫酸溶液能够成原电池,金属铝是负极,故B正确;
C.铜、Al、浓硝酸溶液能够成原电池,铝遇浓硝酸发生钝化,铜作负极,金属铝是正极,故C错误;
D.铁、CuCl2、Al能够成原电池,活泼金属铝是负极,故D正确;
故选C.
点评 本题考查学生原电池的构成条件以及负极的判断,不是活泼金属一定做负极,电子流出的极是负极,难度中等.

练习册系列答案
 全程金卷系列答案
全程金卷系列答案
相关题目
9.能说明氯元素的非金属性比硫元素强的事实是( )
①Cl2与H2S溶液发生置换反应
②受热时H2S能分解,HCl则不能
③单质硫可在空气中燃烧,Cl2不能
④HCl是强酸,H2S是弱酸.
①Cl2与H2S溶液发生置换反应
②受热时H2S能分解,HCl则不能
③单质硫可在空气中燃烧,Cl2不能
④HCl是强酸,H2S是弱酸.
| A. | ①④ | B. | ①② | C. | ③④ | D. | ②④ |
7.一种氢能的制取、贮存及利用如图所示,图示中能量转化方式不涉及( )


| A. | 电能→化学能 | B. | 光能→化学能 | C. | 化学能→电能 | D. | 电能→机械能 |
14.某同学用图甲所示装置及器材,测定碳酸钙与盐酸反应生成CO2气体体积随反应时间变化情况,并绘制出图乙所示曲线.有关分析不正确的是( )


| A. | CaCO3与盐酸的反应为放热反应 | |
| B. | 收集气体最多的时间段为t1~t2 | |
| C. | 平均反应速率:v(t1~t2)>v(t2~t3)>v(0~t1)>v(t3~t4) | |
| D. | 在t4后,收集到的CO2气体不再增加,一定是碳酸钙已完全反应 |
11.元素R 的质量数为A,核内中子数为N,其最高价氧化物R2O5,则ngR 的气态氢化物中所含的质子的物质的量是( )
| A. | (A-N+3)mol | B. | $\frac{n}{A+3}$(A-N+3)mol | C. | $\frac{n}{A}$(A-N+3)mol | D. | $\frac{n}{A+3}$(A-N-3)mol |
8.下列各组中属于同位素关系的是( )
| A. | ${\;}_{19}^{40}$K与${\;}_{20}^{40}$Ca | B. | T2O与 H2O | ||
| C. | ${\;}_{19}^{40}$K与${\;}_{19}^{39}$K | D. | 石墨和碳纳米管 |
9.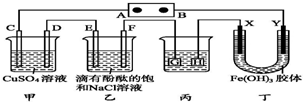 如图装置所示,C、D、E、F、X、Y都是惰性电极,A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.下列叙述正确的是( )
如图装置所示,C、D、E、F、X、Y都是惰性电极,A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.下列叙述正确的是( )
 如图装置所示,C、D、E、F、X、Y都是惰性电极,A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.下列叙述正确的是( )
如图装置所示,C、D、E、F、X、Y都是惰性电极,A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.下列叙述正确的是( )| A. | A是电源的负极 | |
| B. | 若C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为2:1:1:1 | |
| C. | 用丙装置给铜件镀银,则G应是铜件 | |
| D. | 丁中Y极附近的颜色逐渐变深,表明Fe(OH)3胶体胶粒带正电荷 |