题目内容
3.在标准状况下有:①6.72LCH4②3.01x1023个HCl分子③13.6克H2S ④0.2molNH3下列对这四种气体的描述正确的是( )
a.体积②>③>①>④
b.密度②>③>④>①
c.质量②>③>①>④
d.氢原子个数①>③>④>②
| A. | abc | B. | bcd | C. | abd | D. | abcd |
分析 根据n=$\frac{V}{{V}_{m}}$计算6.72LCH4的物质的量,根据n=$\frac{N}{{N}_{A}}$计算HCl的物质的量,根据n=$\frac{m}{M}$计算13.6gH2S的物质的量.
a.相同条件下体积之比等于物质的量之比;
b.相同条件下,密度之比等于摩尔质量之比;
c.根据m=nM计算甲烷、HCl、氨气的质量,据此判断;
d.根据各分子含有的H原子数目,计算各物质含有的H原子物质的量,据此判断.
解答 解:①6.72LCH4的物质的量n=$\frac{V}{{V}_{m}}$=$\frac{6.72L}{22.4L/mol}$=0.3mol,
②3.01×1023个HCl的物质的量n=$\frac{N}{{N}_{A}}$=$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}}$=0.5mol,
③13.6gH2S的物质的量n=$\frac{m}{M}$=$\frac{13.6g}{34g/mol}$=0.4mol,
④0.2molNH3.
a.根据V=nVm知,相同条件下体积之比等于物质的量之比,故体积②>③>①>④,故a正确;
b.根据ρ=$\frac{M}{{V}_{m}}$知,相同条件下,密度之比等于摩尔质量之比,故密度②>③>④>①,故b正确;
c.根据m=nM知,甲烷质量为0.3mol×16g/mol=4.8g,HCl的质量为0.5mol×36.5g/mol=33.25g,氨气的质量为0.2mol×17g/mol=3.4g,故质量②>③>①>④,故c正确;
d.甲烷中n(H)=0.3mol×4=1.2mol,HCl中n(H)=0.5mol,硫化氢中n(H)=0.4mol×2=0.8mol,氨气中n(H)=0.2mol×3=0.6mol,故H原子数目①>③>④>②,故d正确;
故选D.
点评 本题考查了阿伏伽德罗定律及其推论,明确物质的量的基本公式中各个物理量之间的关系是解本题关键,灵活运用基本公式分析解答即可,题目难度中等.

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案| A. | 氢氧化钠的水溶液 | B. | 氢氧化钠的醇溶液 | ||
| C. | 浓硫酸、加热 | D. | 铜、加热 |

| A. | CaCO3与盐酸的反应为放热反应 | |
| B. | 收集气体最多的时间段为t1~t2 | |
| C. | 平均反应速率:v(t1~t2)>v(t2~t3)>v(0~t1)>v(t3~t4) | |
| D. | 在t4后,收集到的CO2气体不再增加,一定是碳酸钙已完全反应 |
| A. | (A-N+3)mol | B. | $\frac{n}{A+3}$(A-N+3)mol | C. | $\frac{n}{A}$(A-N+3)mol | D. | $\frac{n}{A+3}$(A-N-3)mol |
| A. | ${\;}_{19}^{40}$K与${\;}_{20}^{40}$Ca | B. | T2O与 H2O | ||
| C. | ${\;}_{19}^{40}$K与${\;}_{19}^{39}$K | D. | 石墨和碳纳米管 |
| A. | Ba(OH)2•8H2O与NH4Cl的反应 | B. | 乙烯与氧气的反应 | ||
| C. | 盐酸与NaOH溶液的反应 | D. | 铝粉与氧化铁粉末的铝热反应 |
| A. | 乙烯聚合为聚乙烯高分子材料 | B. | 甲烷与氯气制备一氯甲烷 | ||
| C. | 以铜和浓硫酸为原料生产硫酸铜 | D. | 以铜和浓硝酸为原料生产硝酸铜 |
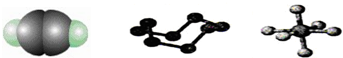
| A. | 32 g S8分子中含有0.125 mol σ键 | |
| B. | SF6是由极性键构成的非极性分子 | |
| C. | 1 mol C2H2分子中有3 mol σ键和2 mol π键 | |
| D. | 1 mol S8中含有8 mol S-S键 |

 ;乙的结构式为
;乙的结构式为 ;
;