题目内容
臭氧O3可以使湿润的淀粉碘化钾试纸变蓝,化学反应式为:2KI+O3+H2O=2KOH+I2+O2;下列叙述中正确的是( )
| A、O3在反应中被氧化成O2 |
| B、反应中氧化产物O2与还原产物I2的物质的量之比为1:1 |
| C、H2O是氧化剂 |
| D、该反应中的还原产物是KOH |
考点:氧化还原反应
专题:氧化还原反应专题
分析:2KI+O3+H2O=2KOH+I2+O2中,I元素的化合价由-1价升高为0,O元素的化合价由0降低为-2价,以此来解答.
解答:
解:A.O元素的化合价降低,则O3在反应中被还原为KOH,故A错误;
B.该反应中氧化产物是碘,还原产物是氢氧化钾,故B错误;
C.反应中O3为氧化剂,KI为还原剂,故C错误;
D.氧元素的化合价由0价变为-2价,所以该反应中的还原产物是KOH,故D正确.
故选D.
B.该反应中氧化产物是碘,还原产物是氢氧化钾,故B错误;
C.反应中O3为氧化剂,KI为还原剂,故C错误;
D.氧元素的化合价由0价变为-2价,所以该反应中的还原产物是KOH,故D正确.
故选D.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素化合价变化为解答的关键,注意分析反应中元素的化合价,侧重氧化还原反应基本概念的考查,题目难度不大.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案
相关题目
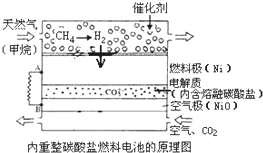 以熔融Li2CO3和K2CO3为电解质,天然气经内重整催化作用提供反应气的燃料电池如图,下列说法不正确的是( )
以熔融Li2CO3和K2CO3为电解质,天然气经内重整催化作用提供反应气的燃料电池如图,下列说法不正确的是( )| A、外电路电子流动方向:由A流向B |
| B、空气极发生反应的离子方程式是O2+4e-=2O2- |
| C、以此燃料电池为电源电解精炼铜,当电路有0.6mol e?转移,有19.2g精铜析出 |
| D、负极反应为H2-2e-+CO32-=CO2+H2O |
下列离子方程式正确的是( )
| A、硫酸铜溶液与足量氢氧化钡溶液混合:Ba2++SO42-═BaSO4↓ |
| B、金属钾与水反应:K+2H2O═K++2OH-+H2↑ |
| C、碳酸氢钙溶液中加入少量氢氧化钠溶液:HCO3-+Ca2++OH-═CaCO3↓+H2O |
| D、次氯酸钙溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O═2HClO+CaSO3↓ |
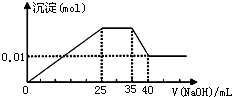 有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:①第一份加足量AgNO3溶液后,有白色沉淀产生.
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99g.
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图.根据上述实验,以下推测不正确的是( )
| A、原溶液一定不存在H+、Cu2+、CO32- |
| B、不能确定原溶液是否含有K+、NO3- |
| C、实验所加的NaOH的浓度为2mol?L-1 |
| D、原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n(NH4+)=1:1:2 |
同周期的X、Y、Z三种元素,已知其最高价氧化物对应的水化物的酸性强弱顺序是:HXO4>H2YO4>H3ZO4,则下列各判断中正确的是( )
| A、原子半径:X>Y>Z |
| B、元素的非金属性:X>Y>Z |
| C、气态氢化物稳定性:X<Y<Z |
| D、原子序数:Z>Y>X |
 黄曲霉素是污染粮食的真菌霉素,其结构如图,人类的特殊基因在黄曲霉素的作用下会发生突变,有转变成肝癌的可能性.下列的说法正确的是( )
黄曲霉素是污染粮食的真菌霉素,其结构如图,人类的特殊基因在黄曲霉素的作用下会发生突变,有转变成肝癌的可能性.下列的说法正确的是( )| A、黄曲霉素能发生取代反应和消去反应 |
| B、1mol黄曲霉素能与6mol氢气发生加成反应 |
| C、1mol黄曲霉素能与含1mol NaOH的水溶液完全反应 |
| D、黄曲霉素能与溴水反应 |
 “水煤气(CO、H2)-空气”燃料电池的工作原理如图所示,其中a、b均
“水煤气(CO、H2)-空气”燃料电池的工作原理如图所示,其中a、b均为惰性电极.下列叙述正确的是( )
| A、甲处通入的是空气,乙处通入的是水煤气 |
| B、a电极发生还原反应,b电极发生氧化反应 |
| C、用该电池电镀铜,若待镀金属增重6.4g,至少消耗标准状况下的水煤气2.24L |
| D、a电极的反应式包括:CO+4OH-+2e-═CO32-+2H2O |
下列物质分类正确的是( )
| A、SO2、CO均为酸性氧化物 |
| B、硅酸、氯化铁溶液均为胶体 |
| C、烧碱、盐酸均为电解质 |
| D、水玻璃、氨水均为混合物 |
下列表示对应化学反应的离子方程式正确的是( )
| A、用NaClO除去水体中CO(NH2)2产生CO2和N2,3ClO-+CO(NH2)2═3Cl-+CO2↑+N2↑+2H2O |
| B、过氧化氢能使酸性KMnO4溶液褪色:3H2O2+2MnO4-+6H+═2Mn2++4O2↑+6H2O |
| C、用小苏打治疗胃酸过多:CO32-+2H+═CO2↑+H2O |
| D、向Ba(OH)2溶液中逐滴加入溶液恰好沉淀完全:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |