题目内容
1.短周期主族元素X、Y、Z、W的原子序数依次增大,Y、Z原子的电子数之比为3:4;X、Z、W三种元素可组成化合物甲,25℃时,0.1mol•L-1甲溶液的pH=13,下列说法正确的是( )| A. | 简单离子半径:W>Z | |
| B. | X和W形成的化合物属于离子化合物 | |
| C. | 由X、Y、Z三种元素组成化合物的水溶液一定显酸性 | |
| D. | Z最简单氢化物分子间存在氢键,故其稳定性强于Y最简单氢化物 |
分析 四种短周期主族元素X、Y、Z、W的原子序数依次增大,X、Z、W三种元素可组成化合物甲,25℃时,0.1mol•L-1甲溶液的pH=13,则甲为碱且为强碱溶液,短周期元素形成的强碱为NaOH,则X、Z、W分别是H、O、Na元素,Y、Z原子的电子数之比为3:4,则Y是C元素,结合元素周期率解答该题.
解答 解:由以上分析可知X为H、Y为C、Z为O、W为Na元素.
A.Z为O、W为Na,二者对应的离子具有相同的核外电子排布,核电荷数越大离子半径越小,则简单离子半径:W<Z,故A错误;
B.X和W形成的化合物为NaH,属于离子化合物,故B正确;
C.X、Y、Z分别是H、C、O元素,三种元素形成的化合物可能是碳酸、醇、醛、羧酸、酯等,碳酸和羧酸具有酸性,但醛、醇、酯等没有酸性,故C错误;
D.稳定性与共价键有关,氢键不属于化学键,故D错误.
故选B.
点评 本题考查原子结构和元素周期律关系,为高频考点,侧重考查学生分析推断及元素周期律的灵活运用,正确推断元素及灵活运用元素周期律是解本题关键,注意C中还要考虑有机物,为易错点.

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目
11.已知R元素的某种同位素能形成化合物AmRn,其中A的化合价为+n.该化合物中一个R微粒的核外电子数为a,核内中子数为b,则该同位素的原子符号是( )
| A. | ${\;}_{a+m}^{b+m+n}R$ | B. | ${\;}_{a+m}^{b+a-m}R$ | C. | ${\;}_{a}^{b+a}R$ | D. | ${\;}_{a-m}^{a-m+b}R$ |
12.完成下列实验所需选择的装置或仪器都正确的是( )
| A | B | C | D | |
| 实验 | 分离汽油和水 | 通过蒸馏乙醇的水溶 液获得无水乙醇 | 分离 CCl4 中的 I2 | 除去 CO2 气体中的 HCl 气体 |
| 装 置 或 仪 器 | 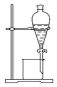 | 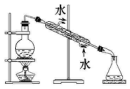 | 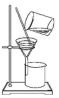 | 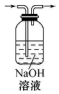 |
| A. | A | B. | B | C. | C | D. | D |
16.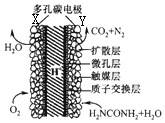 直接尿素电池的结构如图所示,下列说法不正确的是( )
直接尿素电池的结构如图所示,下列说法不正确的是( )
 直接尿素电池的结构如图所示,下列说法不正确的是( )
直接尿素电池的结构如图所示,下列说法不正确的是( )| A. | 电池工作时,化学能转化为电能 | |
| B. | 电池工作时,H+向Y极区迁移,Y极周围溶液的pH减小 | |
| C. | 碳电池采用多孔并用触媒层可加快反应速率 | |
| D. | Y极的电极反应式为H2NCONH2+H2O-6e-═N2↑+CO2+6H+ |
6.如图表示吸热反应、置换反应、氧化还原反应之间的关系,下列反应中,属于Ⅴ区域的是( )
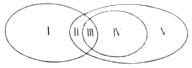

| A. | NaOH+HCl═NaCl+H2O | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | D. | 2Na+2H2O═2NaOH+H2↑ |
10.除去下列括号内杂质的试剂和方法正确的是( )
| A. | Fe3+(Al3+),加过量的氨水,过滤 | |
| B. | KCl溶液(BaCl2),加入足量K2SO4溶液,过滤 | |
| C. | CO2(SO2),饱和碳酸钠溶液,浓硫酸,洗气 | |
| D. | MgCl2溶液(Fe3+):加MgO固体,过滤 |
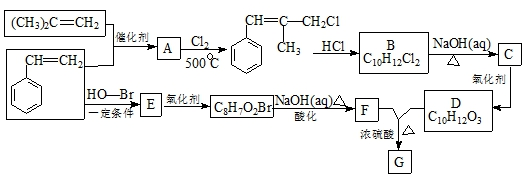
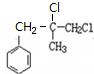 ,B生成C的反应类型为取代反应;
,B生成C的反应类型为取代反应;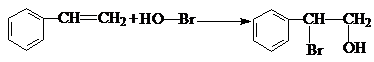 .
.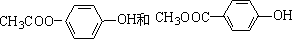 .
. ) 的合成线路:
) 的合成线路: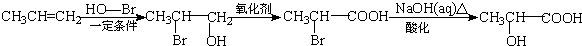 .
.