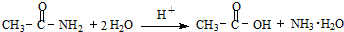题目内容
25℃时,下列各组离子在指定溶液中一定大量共存的是( )
| A、pH=13的溶液:Cu2+、NH4+、NO3-、SO42- |
| B、含0.1 mol/L Fe3+的溶液:NH4+、Na+、Cl-、SO32- |
| C、滴入甲基橙试剂变红色的溶液:Na+、K+、AlO2-、SO42- |
| D、c(H+)=10-13 mol?L-1的溶液:K+、Na+、CO32-、Br- |
考点:离子共存问题
专题:离子反应专题
分析:A.pH=13的溶液呈碱性;
B.与Fe3+反应的离子不能大量共存;
C.滴入甲基橙试剂变红色的溶液呈酸性;
D.c(H+)=10-13 mol?L-1的溶液呈碱性.
B.与Fe3+反应的离子不能大量共存;
C.滴入甲基橙试剂变红色的溶液呈酸性;
D.c(H+)=10-13 mol?L-1的溶液呈碱性.
解答:
解:A.pH=13的溶液呈碱性,在碱性条件下Cu2+、NH4+不能大量共存,故A错误;
B.SO32-与Fe3+发生氧化还原反应而不能大量共存,故B错误;
C.滴入甲基橙试剂变红色的溶液呈酸性,酸性条件下AlO2-不能大量共存,故C错误;
D.c(H+)=10-13 mol?L-1的溶液呈碱性,离子之间不发生任何反应,可大量共存,故D正确.
故选D.
B.SO32-与Fe3+发生氧化还原反应而不能大量共存,故B错误;
C.滴入甲基橙试剂变红色的溶液呈酸性,酸性条件下AlO2-不能大量共存,故C错误;
D.c(H+)=10-13 mol?L-1的溶液呈碱性,离子之间不发生任何反应,可大量共存,故D正确.
故选D.
点评:本题考查离子共存问题,为高考常见题型和高频考点,侧重于学生的分析能力以及元素化合物知识的综合理解和运用的考查,注意把握题目要求以及常见离子的性质和反应类型的判断,答题时注意题给信息,难度不大.

练习册系列答案
相关题目
下列反应中H2O是氧化剂的是( )
| A、CaO+H2O=Ca(OH)2 |
| B、2F2+2H2O=4HF+O2 |
| C、2Na+2H2O=2NaOH+H2↑ |
| D、3NO2+H2O=2HNO3+NO |
下列离子方程式中书写正确的是( )
| A、向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-=Al(OH)3↓ |
| B、硫酸铜与Ba(OH)2溶液反应:Cu2++2OH-═Cu(OH)2↓ |
| C、铁与FeCl3溶液反应:Fe+Fe3+═2Fe2+ |
| D、硝酸银溶液与氯化钠溶液反应:Ag++Cl-═AgCl↓ |
现将ag铁铜镁合金溶于足量的硝酸中,产生的气体是NO、NO2和N2O4的混合物,将该气体与11.2L氧气(标准状况)混合通入足量的水中,气体被完全吸收.向盐酸溶液中加入过量的氢氧化钠溶液,过滤、洗涤、灼烧得到固体的质量为bg.则b-a等于( )
| A、8 | B、16 | C、32 | D、48 |
用石墨电极电解500mLNaNO3和Cu(NO3)2的混合溶液.通电一段时间后,阴、阳两极逸出的气体在标准状况下的体积分别为11.2L和8.4L,求原溶液中Cu2+的物质的量浓度(假设溶液的体积不变)( )
| A、1.25 mol?L-1 |
| B、2.5 mol?L-1 |
| C、0.50 mol?L-1 |
| D、1.0 mol?L-1 |

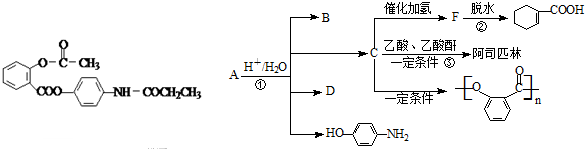
 ]是有机合成中间体,请设计合理的方案以丙酮(
]是有机合成中间体,请设计合理的方案以丙酮( )为唯一有机原料合成2,2-二甲基戊酸(用合成路线流程图表示,并注明反应条件).
)为唯一有机原料合成2,2-二甲基戊酸(用合成路线流程图表示,并注明反应条件).