题目内容
化合物YX2、ZX2中,X、Y、Z的核电荷数都小于18;X原子最外电子层的p能级中有一个轨道填充了2个电子,Y原子的最外电子层中p能级的电子数等于前一电子层的电子总数,且X和Y具有相同的电子层;Z与X在周期表中位于同一主族.回答下列问题:
(1)X原子的电子排布式为 ,Y的轨道表示式为 .
(2)YX2的电子式是 ,分子构型为 ,中心原子Y发生了 杂化.
(3)Y与Z形成的化合物的分子式是 ,该化合物中化学键是 键(填“极性”或“非极性”),该分子属于 分子(填“极性”或“非极性”).
(4)X的氢化物的分子构型为 ,中心原子的杂化形式为 .
(1)X原子的电子排布式为
(2)YX2的电子式是
(3)Y与Z形成的化合物的分子式是
(4)X的氢化物的分子构型为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:核电荷数小于18的三种元素X、Y、Z,X原子最外能层的p能级中有一个轨道填充了2个电子,则X位于最外层电子排布式为ns2np4,为第VIA族元素;
Y原子的最外层中p能级的电子数等于前一能层电子总数,p能级最多排列6个电子,则Y次外层为K层,Y原子最外层p能级上电子数是2,Y原子含有6个电子,为C元素,且X和Y具有相同的电子层,即二者为同一周期元素,所以X是O元素;
Z与X在周期表中位于同一主族,且X和Z原子序数都小于18,所以Z为S元素,结合元素、物质的结构来分析解答.
Y原子的最外层中p能级的电子数等于前一能层电子总数,p能级最多排列6个电子,则Y次外层为K层,Y原子最外层p能级上电子数是2,Y原子含有6个电子,为C元素,且X和Y具有相同的电子层,即二者为同一周期元素,所以X是O元素;
Z与X在周期表中位于同一主族,且X和Z原子序数都小于18,所以Z为S元素,结合元素、物质的结构来分析解答.
解答:
解:依据分析可知:X为氧,Y为碳,Z为硫,
(1)X是O元素,原子序数为8,其最外层有6个电子,所以O的电子排布式为1s22s22p4,Y是C原子,根据构造原理知,其核外电子排布式为:1s22s22p2,所以其轨道表示式为 ,
,
故答案为:1s22s22p2; ;
;
(2)CO2为共价化合物,其电子式为 ,其为直线形分子,中心C原子采取商品杂化方式,故答案为:
,其为直线形分子,中心C原子采取商品杂化方式,故答案为: ;直线;sp;
;直线;sp;
(3)C与S形成的化合物是二硫化碳,分子式为:CS2,二硫化碳中碳原子和硫原子之间存在极性键,但二硫化碳分子中正负电荷重心重合,为非极性分子,故答案为:CS2;极性;非极性;
(4)O的最简单氢化物是水,水分子是V形结构,水分子中键角为104.5°,水分子中含有2对孤电子对,所以碳原子为sp2杂化,
故答案为:V形;sp2.
(1)X是O元素,原子序数为8,其最外层有6个电子,所以O的电子排布式为1s22s22p4,Y是C原子,根据构造原理知,其核外电子排布式为:1s22s22p2,所以其轨道表示式为
 ,
,故答案为:1s22s22p2;
 ;
;(2)CO2为共价化合物,其电子式为
 ,其为直线形分子,中心C原子采取商品杂化方式,故答案为:
,其为直线形分子,中心C原子采取商品杂化方式,故答案为: ;直线;sp;
;直线;sp;(3)C与S形成的化合物是二硫化碳,分子式为:CS2,二硫化碳中碳原子和硫原子之间存在极性键,但二硫化碳分子中正负电荷重心重合,为非极性分子,故答案为:CS2;极性;非极性;
(4)O的最简单氢化物是水,水分子是V形结构,水分子中键角为104.5°,水分子中含有2对孤电子对,所以碳原子为sp2杂化,
故答案为:V形;sp2.
点评:本题考查了元素位置、结构和性质相互关系的应用,涉及杂化方式的判断、电子式的书写、分子空间构型的判断等知识点,根据电子排布正确推断元素是解本题关键,结合价层电子对互斥理论来分析解答,难度中等.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
下列离子方程式书写正确的是( )
| A、碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O |
| B、向氢氧化钠溶液中滴入盐酸:OH-+H+=H2O |
| C、澄清石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O |
| D、铁钉放入硫酸铜溶液中:Fe+3Cu2+=2Fe3++3Cu |
X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若X原子的最外层电子数比其次外层电子数多3个,下列说法不正确的是( )
| X | Y | |
| Z | W |
| A、原子半径:Z>X>Y |
| B、最高价氧化物对应水化物的酸性:Z>W |
| C、W的单质是制取盐酸的原料之一 |
| D、X、W的氢化物相遇会产生白烟 |
下列有关实验原理或实验操作不正确的是( )
A、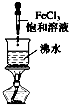 实验室制备氢氧化铁胶体 |
B、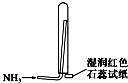 氨气的收集、检验装置 |
C、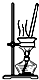 蒸发结晶获得胆矾晶体 |
D、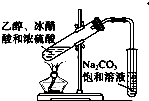 实验室制乙酸乙酯 |
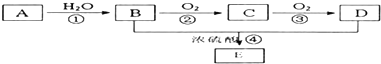
 (其中I、II为未知部分的结构)为推测X的分子结构,进行如图的转化:
(其中I、II为未知部分的结构)为推测X的分子结构,进行如图的转化: