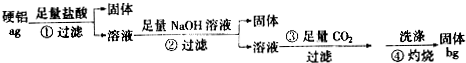
题目内容
16.常温下有浓度均为0.5mol/L的四种溶液:①Na2CO3、②NaHCO3、③HCl、④NH3•H2O
(1)上述溶液中,可发生水解的是①②(填序号).
(2)向④中加入少量氯化铵固体,此时$\frac{c(N{{H}_{4}}^{+})}{c(O{H}^{-})}$的值①②(填“增大”、“减小”、或“不变”).
分析 (1)含有弱酸根和弱碱根离子的盐溶液能够发生水解反应;
(2)加入氯化铵固体后,铵根离子浓度增大,氨水的电离平衡向着逆向移动,则氢氧根离子浓度减小,据此判断该比值.
解答 解:(1)①Na2CO3、②NaHCO3、③HCl、④NH3•H2O中能够发生水解的为:①Na2CO3、②NaHCO3,
故答案为:①②;
(2)NH3•H2O存在电离平衡:NH3•H2O?NH4++OH-,加入氯化铵固体,c(NH4+)增大,平衡逆向移动,c(OH-)减小,则$\frac{c(N{{H}_{4}}^{+})}{c(O{H}^{-})}$的比值增大,
故答案为:增大.
点评 本题考查了弱电解质的电离平衡、盐的水解原理,题目难度不大,明确盐的水解原理为解答关键,注意掌握弱电解质的电离平衡及其影响,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
6.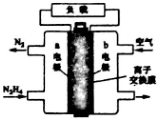 液体燃料电池相比于气体燃料电池具有体积小等优点,一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解溶液.下列关于该电池的叙述正确的是( )
液体燃料电池相比于气体燃料电池具有体积小等优点,一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解溶液.下列关于该电池的叙述正确的是( )
 液体燃料电池相比于气体燃料电池具有体积小等优点,一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解溶液.下列关于该电池的叙述正确的是( )
液体燃料电池相比于气体燃料电池具有体积小等优点,一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解溶液.下列关于该电池的叙述正确的是( )| A. | 放电时,b极附近溶液pH减小 | |
| B. | a极的反应式为N2H4+4OH--4e-═N2↑+4H2O | |
| C. | 放电时,电子从b极经过负载流向a极 | |
| D. | OH-通过阴离子交换膜向a极移动 |
4.下列是部分短周期中第二、第三周期元素的原子半径及主要化合价.
回答下列问题:
(1)⑧在元素周期表中的位置是第二周期VIA族(周期、族);
(2)8个元素的最高价氧化物的水化物中,酸性最强的是HClO4(填化学式);
(3)元素⑤、⑦、⑧分别形成的简单气态氢化物中,⑦的电子式为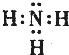 ,稳定性最强的氢化物的结构式为H-O-H;
,稳定性最强的氢化物的结构式为H-O-H;
(4)写出①、④的最高价氧化物对应的水化物之间发生反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O;
(5)用电子式表示元素①与⑥形成化合物的过程 .
.
| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +1 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 |
(1)⑧在元素周期表中的位置是第二周期VIA族(周期、族);
(2)8个元素的最高价氧化物的水化物中,酸性最强的是HClO4(填化学式);
(3)元素⑤、⑦、⑧分别形成的简单气态氢化物中,⑦的电子式为
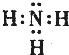 ,稳定性最强的氢化物的结构式为H-O-H;
,稳定性最强的氢化物的结构式为H-O-H;(4)写出①、④的最高价氧化物对应的水化物之间发生反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O;
(5)用电子式表示元素①与⑥形成化合物的过程
 .
.
11.下列化合物中,同分异构体数目超过7个的有( )
| A. | 已烷 | B. | 已烯 | C. | 1,2-二溴丙烷 | D. | 戊醇 |
8.下列说法不正确的是( )
| A. | ${\;}_{6}^{14}$C和${\;}_{6}^{12}$C是同一种核素 | |
| B. | 红磷和白磷互为同素异形体 | |
| C. | CH3COOCH2CH3和CH3CH2COOCH3是不同物质 | |
| D. | CH3CH2OH可看成是由-C2H5和-OH组成 |
 .
. +2H2O.
+2H2O.