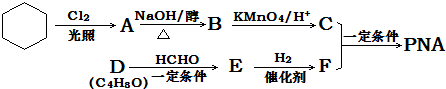
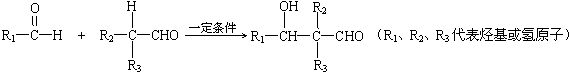
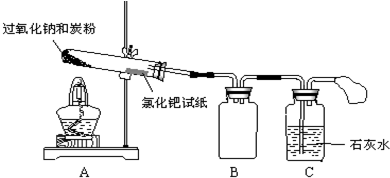
题目内容
在FeCl3、CuCl2的混合溶液里,通入过量的H2S,充分反应后,生成128g沉淀,过滤后,在滤液中加入过量铁粉,不断摇动,使其完全反应后,再滤出过量的铁粉,在氮气的保护下,细心蒸发滤液,可得到796g含有4个结晶水的天蓝色晶体.通过分析和计算,求:
(1)128g沉淀成分的化学式.
(2)796g含有4个结晶水的天蓝色晶体的化学式.
(3)原混合溶液中FeCl3、CuCl2的物质的量.
(1)128g沉淀成分的化学式.
(2)796g含有4个结晶水的天蓝色晶体的化学式.
(3)原混合溶液中FeCl3、CuCl2的物质的量.
考点:有关混合物反应的计算
专题:计算题
分析:(1)根据反应方程式H2S+CuCl2=CuS↓+2HCl、H2S+2FeCl3=S↓+2HCl+2FeCl2判断沉淀的成分;
(2)反应后的溶液中含有氯化亚铁和氯化氢,加入过量铁粉后溶质为氯化亚铁,据此判断796g含有4个结晶水的天蓝色晶体的化学式;
(3)设出氯化铁、氯化铜的物质的量,然后根据反应方程式及沉淀质量、FeCl2?4H2O的质量列式计算出原混合溶液中FeCl3、CuCl2的物质的量.
(2)反应后的溶液中含有氯化亚铁和氯化氢,加入过量铁粉后溶质为氯化亚铁,据此判断796g含有4个结晶水的天蓝色晶体的化学式;
(3)设出氯化铁、氯化铜的物质的量,然后根据反应方程式及沉淀质量、FeCl2?4H2O的质量列式计算出原混合溶液中FeCl3、CuCl2的物质的量.
解答:
解:(1)在FeCl3、CuCl2的混合溶液里,通入过量的H2S,充分反应后发生反应的方程式为:H2S+CuCl2=CuS↓+2HCl、H2S+2FeCl3=S↓+2HCl+2FeCl2,则沉淀为S和CuS,
答:128g沉淀成分的化学式为S和CuS;
(2)过滤后,在滤液中加入过量铁粉,不断摇动,使其完全反应后,再滤出过量的铁粉,此时溶液中溶质为氯化亚铁,
在氮气的保护下,细心蒸发滤液,可得到796g含有4个结晶水的天蓝色晶体只能为FeCl2?4H2O,
答:796g含有4个结晶水的天蓝色晶体的化学式为FeCl2?4H2O;
(3)设原混合液中含有氯化铁xmol、氯化铜ymol,则:
H2S+CuCl2=CuS↓+2HCl H2S+2FeCl3=S↓+2HCl+2FeCl2 2HCl+Fe=H2↑+FeCl2
x x 2x y 0.5y y y 2x+y x+0.5y
根据沉淀的质量可得:96x+32×0.5y=128…①
根据FeCl2?4H2O的质量可得:(x+1.5y)×199=796…②
联立①②解得:x=1、y=2,
答:原混合溶液中FeCl3、CuCl2的物质的量分别为n(CuCl2)=1 mol、n(FeCl3)=2mol.
答:128g沉淀成分的化学式为S和CuS;
(2)过滤后,在滤液中加入过量铁粉,不断摇动,使其完全反应后,再滤出过量的铁粉,此时溶液中溶质为氯化亚铁,
在氮气的保护下,细心蒸发滤液,可得到796g含有4个结晶水的天蓝色晶体只能为FeCl2?4H2O,
答:796g含有4个结晶水的天蓝色晶体的化学式为FeCl2?4H2O;
(3)设原混合液中含有氯化铁xmol、氯化铜ymol,则:
H2S+CuCl2=CuS↓+2HCl H2S+2FeCl3=S↓+2HCl+2FeCl2 2HCl+Fe=H2↑+FeCl2
x x 2x y 0.5y y y 2x+y x+0.5y
根据沉淀的质量可得:96x+32×0.5y=128…①
根据FeCl2?4H2O的质量可得:(x+1.5y)×199=796…②
联立①②解得:x=1、y=2,
答:原混合溶液中FeCl3、CuCl2的物质的量分别为n(CuCl2)=1 mol、n(FeCl3)=2mol.
点评:本题考查了混合物反应的计算,题目难度中等,明确反应原理为解答本题的关键,(3)为难点、易错点,正确分析题干信息,然后根据反应方程式及沉淀的质量、FeCl2?4H2O质量列式计算即可.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案
相关题目
氢气与碘蒸气按1:1体积比混和,使其在一定条件下反应,达到平衡时,碘化氢气体体积占反混合气体体积的50%,则反应混合气体中氢气所占的体积百分比是( )
| A、50% | B、33.3% |
| C、25% | D、20% |
把11g金属混合物加入足量的盐酸中生成5.6LH2(标况),此金属混合物的可能组成为( )
| A、镁、铁 | B、锌、铁 |
| C、铁、铜 | D、镁、钙 |
某温度下,向 2.0L 恒容密闭容器中充入 1.0 molA 和 1.0 molB,发生反应 A(g)+B(g)?C(g)△H<0,经过一段时间后达到平衡.反应过程中测定的部分数据见下表:下列说法正确的是.
| t/s | 0 | 5 | 10 | 20 | 30 |
| n(A)/moL | 1 | 0.8 | 0.75 | 0.70 | 0.70 |
| A、反应在前 5s 的平均速率v (A)=0.04mol?L-1 |
| B、相同温度下,若平衡后再向容器中充入 0.5 mol A 和 0.5 mol C,反应再次达到平衡前v (正)>v (逆) |
| C、相同温度下,若平衡后移走 0.5 mol A 和 0.5 mol B,反应再次达到平衡时 c(C)小于 0.075 mol?L-1 |
| D、相同温度下,若起始时向容器中充入 2.0 mol C,达到平衡时,C 的转化率大于 70% |
关于油脂的说法不正确的是( )
| A、除去试管内壁附着的油脂,可先用热碱溶液洗,再用水洗 |
| B、区别植物油和矿物油可加NaOH溶液,煮沸 |
| C、人体摄入油脂后,在体内酶的催化作用下水解为高级脂肪酸和甘油 |
| D、食用油的种类繁多,主要成份相同,仅是不同食用油添加剂成份不同而以 |
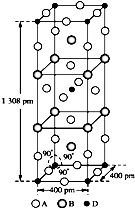 前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子数相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题:
前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子数相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题: