题目内容
6.25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol、285.8kJ/mol、890.3kJ/mol、2800kJ/mol,则下列热化学方程式正确的是( )| A. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-393.5 kJ/mol | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(1)△H=-890.3 kJ/mol | |
| C. | 2H2(g)+O2(g)═2H2O(1)△H=+571.6 kJ/mol | |
| D. | $\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(g)△H=-1400 kJ/mol |
分析 燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,根据燃烧热的定义判断热化学方程式是否正确.
解答 解:A.C完全燃烧应生成CO2,生成CO,反应热小于393.5kJ/mol,故A错误;
B.CH4完全燃烧生成稳定的氧化物为CO2和液态水,故B正确;
C.H2完全燃烧生成的稳定的氧化物为液态水,燃烧热是负值,故C错误;
D.燃烧热为2800kJ/mol,则$\frac{1}{2}$mol葡萄糖完全燃烧放出1400kJ热量,1mol葡萄糖完全燃烧生成CO2和H2O(l),故D错误;
故选B.
点评 本题考查热化学方程式,题目难度不大,本题注意把握燃烧热的概念,特别是水,稳定状态为液态.

练习册系列答案
相关题目
18.化学是一门以实验为基础的科学,掌握好化学实验基本操作是做好化学实验的前提.下列实验操作正确的是( )
| A. | 制取蒸馏水时,冷却水应从冷凝管的上端进入 | |
| B. | 分液时,应把下层液体从下端放出后,再把上层液体从下端放出 | |
| C. | 过滤时,漏斗的下端应紧贴烧杯内壁 | |
| D. | 萃取时,所选的萃取剂的密度应比原溶液的密度大 |
15.某反应的反应物与生成物有:K2Cr2O7、KCl、CrCl3、Cl2、HCl、H2O,已知氧化性K2Cr2O7>Cl2,则下列说法不正确的是( )
| A. | 氧化剂和还原剂的物质的量之比为1:14 | |
| B. | Cl2是该反应的氧化产物 | |
| C. | 当转移0.2mol电子时,被氧化的还原剂的物质的量为0.2mol | |
| D. | 由此反应可知还原性HCl>CrCl3 |
16.2010年12月13日成都绕城高速137辆车因雾连环追尾,造成不同程度受损.雾属于下列分散系中的( )
| A. | 乳浊液 | B. | 溶液 | C. | 胶体 | D. | 悬浊液 |
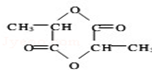 +2H2O.
+2H2O.