题目内容
氨是最重要的化工产品之一.其生产方法也在逐渐改进中,各国科学家均在为提高氨的产量,降低能耗做各种有益的探究.试运用所学知识,解决下列问题:
(1)合成氨用的H2可以用CH4为原料制得.其总反应方程式为:CH4(g)+H2O(g)?CO(g)+3H2(g)
①对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则上述反应的KP= .该反应的△S 0,(填“>”、“=”或“<”).
②能说明该反应达到平衡状态的是 .
A.v(CH4)═3v(H2)
B.恒容容器中,体系的压强不再改变
C.恒容容器中,体系中气体的密度不再改变
D.恒容容器中,气体的摩尔质量不再改变
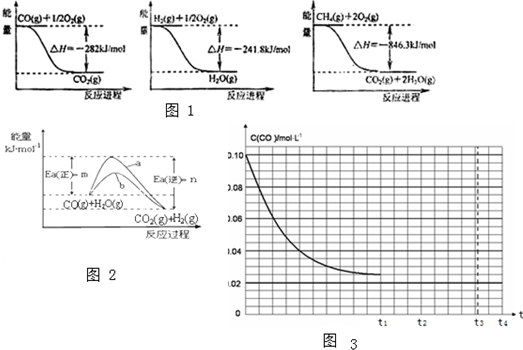
(2)有关化学反应的能量变化如图1所示.则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式: .
(3)合成氨用的H2还可用水煤气为原料制得.其总反应方程式为:CO(g)+H2O(g)?CO2(g)+H2(g)
①图2是在一定条件下发生上述反应时,反应物和生成物能量与活化能的关系.在图2中曲线 (填“a”或“b”)表示加入催化剂的能量变化曲线,催化剂能加快反应速率的原因是 ;
②已知该反应平衡常数随温度的变化如下:
在500℃时将0.2mol CO和0.2mol H2O放入容积为2L的密闭容器中,t1时达到平衡,反应过程中c(CO)随时间t变化趋势曲线如图3所示.若其他条件不变,t1时将容器体积先迅速压缩到1L,t2时迅速升温至800℃,t3重新达到平衡.画出t1-t4的c(CO)随时间t变化趋势曲线.

(1)合成氨用的H2可以用CH4为原料制得.其总反应方程式为:CH4(g)+H2O(g)?CO(g)+3H2(g)
①对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则上述反应的KP=
②能说明该反应达到平衡状态的是
A.v(CH4)═3v(H2)
B.恒容容器中,体系的压强不再改变
C.恒容容器中,体系中气体的密度不再改变
D.恒容容器中,气体的摩尔质量不再改变
(2)有关化学反应的能量变化如图1所示.则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式:
(3)合成氨用的H2还可用水煤气为原料制得.其总反应方程式为:CO(g)+H2O(g)?CO2(g)+H2(g)
①图2是在一定条件下发生上述反应时,反应物和生成物能量与活化能的关系.在图2中曲线
②已知该反应平衡常数随温度的变化如下:
| 温度 | 400 | 500 | 800 |
| 平衡常数 | 9.94 | 9 | 1 |
考点:反应热和焓变,热化学方程式,化学反应速率的影响因素,化学平衡状态的判断,物质的量或浓度随时间的变化曲线
专题:基本概念与基本理论
分析:(1)①依据化学平衡常数表达式的书写方法书写,正反应为气体体积增大的反应;
②化学平衡状态判断的关键是正逆反应速率相等和各组分浓度不变;
(2)依据图象分析反应过程都是能量降低的过程,说明反应是放热反应;写出对应热化学方程式,依据盖斯定律计算得到所需热化学方程式;
(3)①催化剂通过降低反应的活化能来加快反应速率;
②据影响平衡移动的因素分析.
②化学平衡状态判断的关键是正逆反应速率相等和各组分浓度不变;
(2)依据图象分析反应过程都是能量降低的过程,说明反应是放热反应;写出对应热化学方程式,依据盖斯定律计算得到所需热化学方程式;
(3)①催化剂通过降低反应的活化能来加快反应速率;
②据影响平衡移动的因素分析.
解答:
解:(1)①根据化学平衡常数表达式的写法可知,KP=
,正反应气体体积增大,△S>0,故答案为:
;>;
②A、不能说明正逆反应速率相等,故A错误;
B、反应前后气体体积不同,所以压强不变说明各组分浓度不变了,反应达到平衡状态,故B正确;
C、体积不变,反应物互为生成物都是气体,质量不变,所以密度不变不能说明反应达到平衡状态,故C错误;
D、平均相对分子质量不变,说明气体物质的量不变了,各组分浓度不变了,反应达到平衡状态,故D正确;
故选BD;
(2)图1中各反应的热化学方程式为:
①CO(g)+
O2(g)=CO2(g)△H=-282KJ/mol
②H2(g)+
O2(g)=H2O(g)△H=-241.8KJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-846.3KJ/mol
由盖斯定律③-②×3-①得到:CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=+161.1kJ?mol-1,
故答案为:CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=+161.1kJ?mol-1;
(3)①催化剂通过降低反应的活化能,增大活化分子的百分数,从而增大有效碰撞的次数,达到加快反应速率的目的,
故答案为:b;催化剂能降低该反应的活化能,提高了活化分子的百分数,有效碰撞的次数增加,化学反应速率加快;
②反应前后气体体积不变,容器体积从2L变为1L时,平衡不发生移动,只是CO的浓度变为原来的2倍;平衡常数随温度的升高而减小,说明正反应放热,温度升高时平衡向吸热的逆向移动,CO浓度增大;如图 ,
,
故答案为:
| P3(H2)?P(CO) |
| P(CH4)?P(H2O) |
| P3(H2)?P(CO) |
| P(CH4)?P(H2O) |
②A、不能说明正逆反应速率相等,故A错误;
B、反应前后气体体积不同,所以压强不变说明各组分浓度不变了,反应达到平衡状态,故B正确;
C、体积不变,反应物互为生成物都是气体,质量不变,所以密度不变不能说明反应达到平衡状态,故C错误;
D、平均相对分子质量不变,说明气体物质的量不变了,各组分浓度不变了,反应达到平衡状态,故D正确;
故选BD;
(2)图1中各反应的热化学方程式为:
①CO(g)+
| 1 |
| 2 |
②H2(g)+
| 1 |
| 2 |
③CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-846.3KJ/mol
由盖斯定律③-②×3-①得到:CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=+161.1kJ?mol-1,
故答案为:CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=+161.1kJ?mol-1;
(3)①催化剂通过降低反应的活化能,增大活化分子的百分数,从而增大有效碰撞的次数,达到加快反应速率的目的,
故答案为:b;催化剂能降低该反应的活化能,提高了活化分子的百分数,有效碰撞的次数增加,化学反应速率加快;
②反应前后气体体积不变,容器体积从2L变为1L时,平衡不发生移动,只是CO的浓度变为原来的2倍;平衡常数随温度的升高而减小,说明正反应放热,温度升高时平衡向吸热的逆向移动,CO浓度增大;如图
 ,
,故答案为:

点评:本题考查了化学平衡常数的书写、盖斯定律的应用、催化剂的原理、平衡移动,题目有一定难度.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
下列说法或表示方法正确的是( )
| A、反应物总能量低于生成物总能量时,该反应不能发生 |
| B、氢气燃烧热的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ/mol |
| C、甲烷是清洁、无污染的化石燃料 |
| D、氢气是热值高、无污染的燃料 |